题目内容
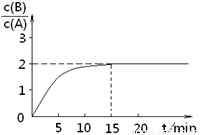
 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)?B(g)+C(g);△H=-48.25kJ?mol-1反应过程中时间t与A、B浓度有下图所示关系,若测得第15min时c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、该温度下此反应平衡常数为3.2 | B、A的初始物质的量为4 mol | C、反应到达平衡的过程中,放出的热量是154.4kJ | D、如使反应最终c(B)/c(A)=3,只能降低反应温度 |
分析:由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol?L-1,
=2,故平衡时c(A)=0.8mol/L;
A.根据浓度变化量之比等于化学计量数之比计算平衡时c(C),代入平衡常数表达式k=
计算;
B.根据浓度变化量之比等于化学计量数之比计算△c(A),A的平衡浓度+△c(A)=A的起始浓度,再根据n=cV计算;
C.计算参加反应的A的物质的量,结合热化学方程式计算放出的热量;
D.要使
=3,应改变条件使c(B)增大,c(A)降低,结合外界条件对平衡影响分析.
| c(B) |
| c(A) |
A.根据浓度变化量之比等于化学计量数之比计算平衡时c(C),代入平衡常数表达式k=
| c(B)?c(C) |
| c2(A) |
B.根据浓度变化量之比等于化学计量数之比计算△c(A),A的平衡浓度+△c(A)=A的起始浓度,再根据n=cV计算;
C.计算参加反应的A的物质的量,结合热化学方程式计算放出的热量;
D.要使
| c(B) |
| c(A) |
解答:解:由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol?L-1,
=2,故平衡时c(A)=0.8mol/L;
A.浓度变化量之比等于化学计量数之比,故平衡时c(C)=c(B)=1.6mol?L-1,故平衡常数表达式k=
=
=0.04,故A错误;
B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol?L-1=3.2mol?L-1,A的起始浓度为3.2mol?L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,故B错误;
C.参加反应的A的物质的量为3.2mol/L×2L=6.4mol,故放出的热量为48.25kJ×
=154.4kJ,故C正确;
D.要使
=3,应改变条件使c(B)增大,c(A)降低,可以只增大B的浓度,该反应为放热反应,可以降低温度使平衡向正反应进行,故D错误;
故选C.
| c(B) |
| c(A) |
A.浓度变化量之比等于化学计量数之比,故平衡时c(C)=c(B)=1.6mol?L-1,故平衡常数表达式k=
| c(B)?c(C) |
| c2(A) |
| 1.6×1.6 |
| 0.82 |
B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol?L-1=3.2mol?L-1,A的起始浓度为3.2mol?L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,故B错误;
C.参加反应的A的物质的量为3.2mol/L×2L=6.4mol,故放出的热量为48.25kJ×
| 6.4mol |
| 2 |
D.要使
| c(B) |
| c(A) |
故选C.
点评:本题考查化学平衡图象、有关计算、影响平衡的因素等,注意D选项,反应前后气体的体积不变,只降低A的浓度所到达的平衡状态与原平衡状态为等效平衡,c(B)/c(A)值不变.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
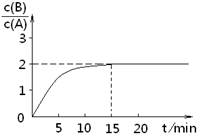
 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1
反应过程中时间t与A、B浓度有如图关系,若测得第15min时
c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
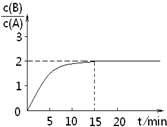
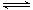 B(g)+C(g);ΔH =-48.25 kJ
· mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH =-48.25 kJ
· mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,则下列结论正确的是