摘要:下图中B和.等都是A和Cl2发生反应生成的产物.E是一种高分子化合物.透光性能好.常用作一些灯饰外壳.过程中一些小分子都已经略去.(提示:回答本题可能用到前面有关题所给的信息) ⑴反应条件A为 .化合物B的结构简式为: ⑵与反应②条件相同的反应为 .与反应⑤类型相同的反应为 . ⑶写出反应④和⑦的化学方程式: 反应④: 反应⑦:
网址:http://m.1010jiajiao.com/timu3_id_247033[举报]
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:
(4)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)
(5)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
查看习题详情和答案>>

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)
BDCA 或 CBDA 或BCDA等
BDCA 或 CBDA 或BCDA等
.(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
D
D
.A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(4)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)
CaCO3+SiO2
CaSiO3+CO2↑
| ||
CaCO3+SiO2
CaSiO3+CO2↑
.
| ||
(5)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是
在HCl气流中加热脱水(防止MgCl2水解)
在HCl气流中加热脱水(防止MgCl2水解)
.(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
H2O+Na2SO3+Br2═Na2SO4+2HBr
H2O+Na2SO3+Br2═Na2SO4+2HBr
..海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
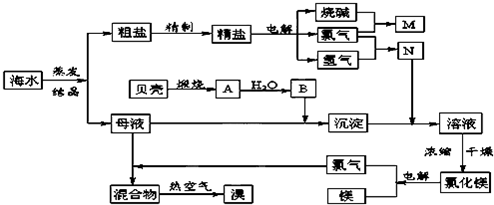
请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)
(2)Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,需要进行的实验操作依次
A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的电极反应方程式:
(5)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)
(6)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是
(7)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
查看习题详情和答案>>

请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液.
则加入试剂的顺序是(填编号)
C B D A或B C D A
C B D A或B C D A
.(2)Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,需要进行的实验操作依次
DEC
DEC
.A.蒸馏 B.灼烧 C.过滤 D.蒸发 E.冷却结晶
(3)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是
D
D
.A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(4)写出电解饱和NaCl溶液的电极反应方程式:
2Cl--2e-═Cl2↑:2H++2e-═H2↑;
2Cl--2e-═Cl2↑:2H++2e-═H2↑;
.(5)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)
CaCO3+SiO2
CaSiO3+CO2
| ||
CaCO3+SiO2
CaSiO3+CO2
.
| ||
(6)利用MgCl2?6H2O可制得无水氯化镁,应采取的措施是
要在HCl气流中脱水,
要在HCl气流中脱水,
.(7)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
2Na2SO3+Br2+H2O=2Na2SO4+2HBr
2Na2SO3+Br2+H2O=2Na2SO4+2HBr
.近年来,地震、洪水、泥石流等各种自然灾害频发,灾害过后,对环境进行消毒杀菌、获取洁净的饮用水都需要大量消毒剂,开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(2)氯氨(NH2Cl)可作杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:___________________。
(3)氯溴海因(C5H6BrClN2O2)是一种比较安全的氯气和氯制剂的替代产品,其结构简式如图所示。氯溴海因在水中的水解过程比较复杂,主要生成次卤酸和海因,请写出海因的结构简式:____________。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(2)氯氨(NH2Cl)可作杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:___________________。
(3)氯溴海因(C5H6BrClN2O2)是一种比较安全的氯气和氯制剂的替代产品,其结构简式如图所示。氯溴海因在水中的水解过程比较复杂,主要生成次卤酸和海因,请写出海因的结构简式:____________。

(4)过碳酸钠是一种多用途的新型固体漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。下列物质中不能使过碳酸钠失效的是________(填序号)。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.NaHCO3溶液
(5)消毒剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为: HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时,转移的电子数是______。
查看习题详情和答案>>
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.NaHCO3溶液
(5)消毒剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为: HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时,转移的电子数是______。
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)B元素在元素周期表中的位置是第
(2)画出D元素的原子结构示意图
 .
.
(3)与E的氢化物分子所含电子总数相等的分子是
(4)A与C形成的化合物中含有化学键的类型是
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为
查看习题详情和答案>>
(1)B元素在元素周期表中的位置是第
三
三
周期IA
IA
族.(2)画出D元素的原子结构示意图


(3)与E的氢化物分子所含电子总数相等的分子是
H2O
H2O
(举一例、填化学式,下同)、离子是OH-
OH-
.(4)A与C形成的化合物中含有化学键的类型是
共价键
共价键
.(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为
Cl2+2OH-=ClO-+Cl-+H2O
Cl2+2OH-=ClO-+Cl-+H2O
. N2+3Cu+3H2O.备选仪器装置如下(装置内所发生的反应是完全的).
N2+3Cu+3H2O.备选仪器装置如下(装置内所发生的反应是完全的).
