网址:http://m.1010jiajiao.com/timu3_id_246668[举报]
(14分)金属氢化物-镍(MH—Ni)电池由于其高能、安全、无污染、无记忆效应、价格适宜,已成为目前最具发展前景的“绿色能源”电池之一,电池总反应为MH+NiOOH  M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
(1)写出放电时的负极反应_________________
(2)充电时,阳极的电极反应为__________________
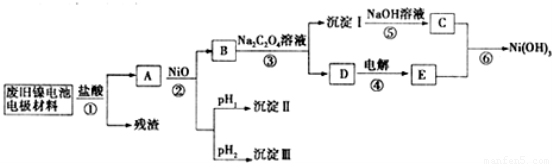
镍氢电池正极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(3)根据上表数据判断步骤②先析出的沉淀Ⅱ为 ,后析出的沉淀为Ⅲ为__________________(填化学式),则pH1 pH2(填填“>”、“=”或“<”),
(4)已知溶解度:NiC2O4 > NiC2O4·H2O > NiC2O4·2H2O,则③的化学方程式是 。
(5)④中阳极的电极反应为 ,验证阳极产物的试剂为 。
(6)试写出⑥的离子方程式 。 查看习题详情和答案>>
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ ?????? 和沉淀Ⅲ ????? (填化学式),则pH1 ???????? pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 ?????? 。
A.pH试纸???????? B.石蕊指示剂 ?????? C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 ???????????????????????? .第③步反应后,过滤沉淀时需要的玻璃仪器有???? .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 ????????????? 、???????????? 。
(3)④中阳极反应产生的气体E为 ??????????? ,验证该气体的试剂为 ???????? 。
(4)试写出反应⑥的离子方程式_____________________________________________
查看习题详情和答案>>
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | | |
| pH | | | |
| 开始沉淀 | 沉淀完全 | | |
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ______
 ____(填化学式)。
____(填化学式)。(2) 写出加入Na2C2O4溶液的反应的化学方程式: 。
(3) 检验电解滤液时阳极产生的气体的方法: 。
(4) 写出“氧化”反应的离子方程式: 。
(5) 如何检验Ni(OH)3已洗
 涤干净? 。
查看习题详情和答案>>
涤干净? 。
查看习题详情和答案>>
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | ||
| pH | |||
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)用NiO调节溶液的pH,依次析出沉淀Ⅰ______和沉淀Ⅱ______(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:______.
(3)检验电解滤液时阳极产生的气体的方法:______.
(4)写出“氧化”反应的离子方程式:______.
(5)如何检验Ni(OH)3已洗涤干净?______. 查看习题详情和答案>>
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹).

(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱.
①选择合理的装置连接:______→______→______(填字母编号).
②选择所需的试剂:______(填字母编号).
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:______.
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4?7H2O晶体,设计实验流程如下:

已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(1)根据上表数据判断操作2依次析出的沉淀I是______沉淀II是______(填化学式),pH1______pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为______.
(3)“调节pH为2-3”的目的是______;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______. 查看习题详情和答案>>