题目内容
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹).
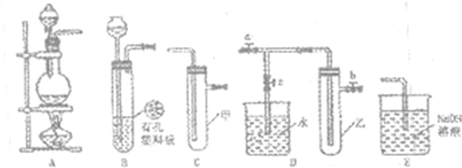
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱.
①选择合理的装置连接:______→______→______(填字母编号).
②选择所需的试剂:______(填字母编号).
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:______.
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4?7H2O晶体,设计实验流程如下:
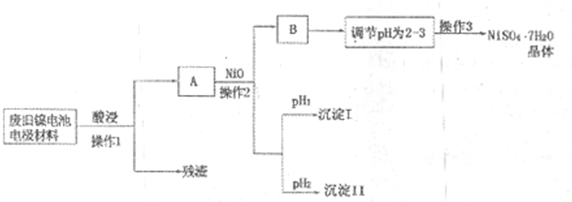
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
(1)根据上表数据判断操作2依次析出的沉淀I是______沉淀II是______(填化学式),pH1______pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为______.
(3)“调节pH为2-3”的目的是______;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是______.
解:(Ⅰ)①验证Cl-和Br-的还原性强弱可根据反应Cl2+2Br-=2Cl-+Br2设计实验,在A装置中制备氯气,生成的气体通入到装有溴化钠溶液的C中,最后剩余的氯气要用盛氢氧化钠溶液的装置E吸收多余的氯气,防止污染空气,合理的装置连接为A、C、E;
故答案为:A、C、E;
②试剂选择二氧化锰和浓盐酸加热反应生成氯气,多余的氯气被氢氧化钠溶液吸收,试剂为bdf;
故答案为:bdf;
③依据实验设计,反应后生成黄绿色气体氯气,通入溴化钠溶液中,氯气氧化溴离子为单质溴,溶液变为橙色,证明氯气的氧化性大于氧化产物溴单质;如烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴,则Br-的还原性强于Cl-;
故答案为:烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴,则Br-的还原性强于Cl-;
(Ⅱ)(1)根据金属氢氧化物的Kap及沉淀析出的理论pH,结合流程图可知,先沉淀的是三价铁离子,沉淀pH范围是2.53~2.94,随后沉淀的是三价铝离子,沉淀pH的范围3.43~4.19,所以pH1<pH2,析出的沉淀I是Fe(OH)3,沉淀II是Al(OH)3,故答案为:Fe(OH)3;Al(OH)3;<;
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗,故答案为:漏斗;
(3))“调节pH为2-3”的目的是防止Ni2+水解,得到较纯净的晶体,故答案为:防止Ni2+水解;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是:2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O,
故答案为:2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O.
分析:(Ⅰ)验证Cl-和Br-的还原性强弱可根据反应Cl2+2Br-=2Cl-+Br2设计实验;
(Ⅱ)废旧镍电池电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,根据流程图,加入盐酸,其中碳粉不反应得到残渣.得到溶液A的推断,利用题中给的信息,NiCl2易溶于水,Fe3+不能氧化Ni2+,推知A中含有被盐酸溶解生成的Ni2+、Fe3+、AI3+三种离子;
(1)由题给条件,金属氢氧化物的Kap及沉淀析出的理论pH,可知,在A溶液中加入NiO是为了调节溶液PH,使相应的铝离子、三价铁离子全部沉淀出,Ni2+在溶液B中.根据PH可以确定开始析出沉淀和全部沉淀的PH范围,先析出沉淀Ⅱ是Fe(OH)3,沉淀PH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以PH1<PH2;
(2)操作1和操作2是过滤操作,分离沉淀;
(3)依据图表数据分析,调节PH2-3蒸发结晶得到NiSO4?7H2O晶体,目的是得到较纯净的晶体;
(4)依据NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH,次氯酸钠被还原为氯离子,结合电荷守恒、原子守恒写出.
点评:本题考查了金属回收的基本方法、难溶电解质的溶解与沉淀应用、沉淀转化的条件,铝、铁、镍元素化合物的化学性质,离子的沉淀PH范围,物质的分离、提纯的方法,实验基本操作等.题目难度中等.
故答案为:A、C、E;
②试剂选择二氧化锰和浓盐酸加热反应生成氯气,多余的氯气被氢氧化钠溶液吸收,试剂为bdf;
故答案为:bdf;
③依据实验设计,反应后生成黄绿色气体氯气,通入溴化钠溶液中,氯气氧化溴离子为单质溴,溶液变为橙色,证明氯气的氧化性大于氧化产物溴单质;如烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴,则Br-的还原性强于Cl-;
故答案为:烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴,则Br-的还原性强于Cl-;
(Ⅱ)(1)根据金属氢氧化物的Kap及沉淀析出的理论pH,结合流程图可知,先沉淀的是三价铁离子,沉淀pH范围是2.53~2.94,随后沉淀的是三价铝离子,沉淀pH的范围3.43~4.19,所以pH1<pH2,析出的沉淀I是Fe(OH)3,沉淀II是Al(OH)3,故答案为:Fe(OH)3;Al(OH)3;<;
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗,故答案为:漏斗;
(3))“调节pH为2-3”的目的是防止Ni2+水解,得到较纯净的晶体,故答案为:防止Ni2+水解;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH.该反应的离子方程式是:2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O,
故答案为:2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O.
分析:(Ⅰ)验证Cl-和Br-的还原性强弱可根据反应Cl2+2Br-=2Cl-+Br2设计实验;
(Ⅱ)废旧镍电池电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,根据流程图,加入盐酸,其中碳粉不反应得到残渣.得到溶液A的推断,利用题中给的信息,NiCl2易溶于水,Fe3+不能氧化Ni2+,推知A中含有被盐酸溶解生成的Ni2+、Fe3+、AI3+三种离子;
(1)由题给条件,金属氢氧化物的Kap及沉淀析出的理论pH,可知,在A溶液中加入NiO是为了调节溶液PH,使相应的铝离子、三价铁离子全部沉淀出,Ni2+在溶液B中.根据PH可以确定开始析出沉淀和全部沉淀的PH范围,先析出沉淀Ⅱ是Fe(OH)3,沉淀PH范围是2.53~2.94,然后析出沉淀Ⅲ是Al(OH)3,沉淀PH的范围3.43~4.19,所以PH1<PH2;
(2)操作1和操作2是过滤操作,分离沉淀;
(3)依据图表数据分析,调节PH2-3蒸发结晶得到NiSO4?7H2O晶体,目的是得到较纯净的晶体;
(4)依据NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH,次氯酸钠被还原为氯离子,结合电荷守恒、原子守恒写出.
点评:本题考查了金属回收的基本方法、难溶电解质的溶解与沉淀应用、沉淀转化的条件,铝、铁、镍元素化合物的化学性质,离子的沉淀PH范围,物质的分离、提纯的方法,实验基本操作等.题目难度中等.

练习册系列答案
相关题目

 某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.
某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.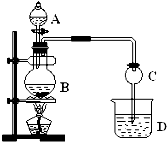 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题: