网址:http://m.1010jiajiao.com/timu3_id_246376[举报]
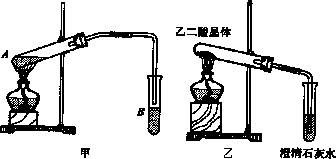
Ⅰ.探究乙酸、碳酸和硅酸的酸性强弱关系,该小组设计了如下实验装置(夹持仪器已略去)。

(1)实验前如何检查装置A的气密性?______________________________。
(2)装置A中反应产生的气体通入试管B溶液中,有白色胶状沉淀生成,说明碳酸酸性比硅酸强。
有学生认为B中的实验现象不足以证明碳酸的酸性比硅酸强,理由是:
a.乙酸易挥发,乙酸气体随CO2气体进入试管B的溶液中,和硅酸钠溶液反应生成沉淀。
b.该复分解反应生成的硅酸是难溶固体,不能说明是因为生成弱酸而发生反应。
为了证明碳酸能和硅酸钠反应生成硅酸沉淀,下列方法中可行的是__________(填序号)。
①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶
②在仪器A、B之间连接装有足量碱石灰的干燥管
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶
④用碳酸钠粉末代替大理石进行实验
下列能够说明碳酸比硅酸酸性强的事实是__________(填序号)。
①相同温度时,碳酸的溶解度比硅酸的溶解度大
②碳酸比硅酸易分解
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小
④常温下,CO2是气体,SiO2是固体
Ⅱ.证明乙酸为弱酸。
现有常温下pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:________________________________________。
查看习题详情和答案>> (2013?安徽模拟) X、Y、Z、Q、W、R六种短周期元素原子序数依次增大.化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成;请回答以下问题:
(2013?安徽模拟) X、Y、Z、Q、W、R六种短周期元素原子序数依次增大.化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成;请回答以下问题:(1)Q的原子结构示意图为


(2)Y元素的单质能发生如图所示的转化,则Y元素为
(3)W的单质既能与甲溶液反应,又能与乙溶液反应.
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为Q
下列表述中证明这一事实的是
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c.W的原子序数大.
| |||||||||||||||||||||||
(15分)氨是最重要的化工产品之一。
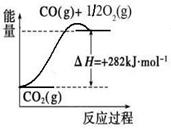
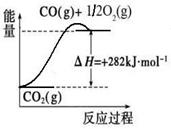
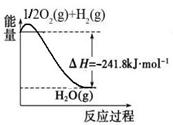
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)  CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。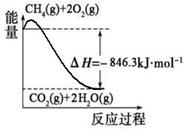

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g) [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。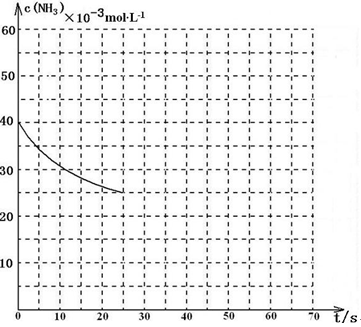
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3) 查看习题详情和答案>>
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)
 CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。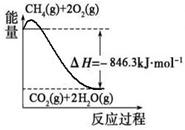
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO] (l)+CO(g)+NH3(g)
 [Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。
[Cu(NH3)3] CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 。(填写选项编号)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(g) △H<0
CO(NH2)2(l)+H2O(g) △H<0某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为_________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
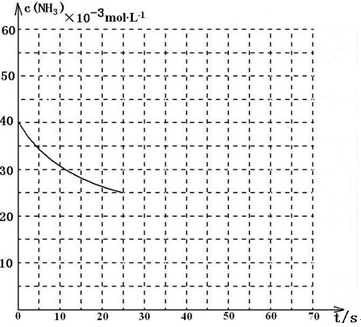
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)