摘要: 下列气体相遇不会产生白烟现象的是 A.NH3和HCl B.NH3和HNO3蒸汽 C.NH3和O2 D.NH3和HBr
网址:http://m.1010jiajiao.com/timu3_id_244433[举报]
 研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:
研究性学习小组为探究Cu与浓H2SO4反应及其产物SO2的性质,设计如下实验装置:(1)写出铜与浓硫酸反应的化学方程式:
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
;浸有碱液的棉花的作用是:
| ||
吸收SO2防止污染空气
吸收SO2防止污染空气
.(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO2的性质,经过同学间的讨论和与老师的交流,设计了如图实验装置.

①对试管A中的浓H2SO4和铜丝进行加热,发现E试管中有气泡逸出,品红溶液 很快褪色,但最终 未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
生成了溶解度较大的Ba(HSO3)2
生成了溶解度较大的Ba(HSO3)2
.②为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成实验报告.
| 实验方案 | 现象 |
| 1取少量溶液于试管中,加入氢氧化钠溶液 | |
| 2取少量溶液于试管中,加入稀盐酸,加热,用湿润的蓝色石蕊试纸检验生成的气体. |
A D
A D
(填写字母编号).A.铝粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(4)请写出长导管B的作用
防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓入空气,
以排尽A中的二氧化硫气体,不会产生污染等)
以排尽A中的二氧化硫气体,不会产生污染等)
防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓入空气,
以排尽A中的二氧化硫气体,不会产生污染等)
(只写一点就可).以排尽A中的二氧化硫气体,不会产生污染等)
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体[FeSO4?7H2O]和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
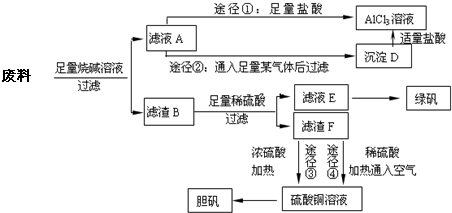
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是
(5)途径③发生的反应中,体现了浓硫酸
查看习题详情和答案>>

回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体其固态可用于人工降雨,则该气体是
CO2
CO2
(填化学式),滤液A与过量的某气体生成沉淀D的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
.你认为较合理的途径是②
②
(填①或②),理由是途径①会引入盐酸,氯化钠杂质
途径①会引入盐酸,氯化钠杂质
.(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了Fe2+和H+外,还最可能存在的阳离子是
Fe3+
Fe3+
(用离子符号表示),检测该离子的方法是取滤液E少量于试管中,滴入2~3滴KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+
取滤液E少量于试管中,滴入2~3滴KSCN溶液,若出现血红色,则证明滤液E中含有Fe3+
.(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是
产生等量胆矾途径④消耗硫酸少
产生等量胆矾途径④消耗硫酸少
、途径④不会产生污染大气的气体
途径④不会产生污染大气的气体
.(5)途径③发生的反应中,体现了浓硫酸
强氧化
强氧化
性和酸
酸
性.通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤
过滤
、自然干燥.其中途径④发生的反应为2Cu+O2+4H+=2Cu2++2H2O
2Cu+O2+4H+=2Cu2++2H2O
(用一个离子方程式表示).