网址:http://m.1010jiajiao.com/timu3_id_24303[举报]

[实践运用]根据复分解反应的知识,该反应的化学反应方程式为:
[挖掘实质]
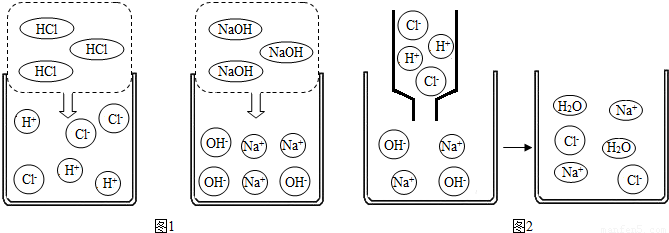
(1)图1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸铜在水中会解离出的离子是
(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为:H++OH-=H2O
我也能用同样的方式表示碳酸钠溶液与氯化钡溶液之间发生反应时有沉淀生成的反应实质
[猜想与假设]该小组对滤液中溶质的成分作出了两种合理的假设.
假设①:溶质为NaCl
假设②:溶质为NaCl、BaCl2
请你再补充一种合理的假设.
假设③:溶质为
[实验探究]如果假设③成立,请你根据下表实验方案,完成空格.
| 实验步骤及操作方法 | 实验现象 | 结 论 |
| a、向装有滤液的烧杯中滴加 硝酸银溶液 |
有白色沉淀产生 有白色沉淀产生 |
假设③成立 |
| b、过滤后,向白色沉淀中加入足量的 稀硝酸 稀硝酸 . |
白色沉淀部分溶解,且有 气泡 气泡 产生 |
[实践运用]根据复分解反应的知识,该反应的化学反应方程式为:______.
[挖掘实质]
(1)图1是HCl和NaOH在水中解离出离子的示意图,小丽发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸铜在水中会解离出的离子是______(填离子符号)______.
(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为:H++OH-=H2O
我也能用同样的方式表示碳酸钠溶液与氯化钡溶液之间发生反应时有沉淀生成的反应实质______.
[猜想与假设]该小组对滤液中溶质的成分作出了两种合理的假设.
假设①:溶质为NaCl
假设②:溶质为NaCl、BaCl2
请你再补充一种合理的假设.
假设③:溶质为______.
[实验探究]如果假设③成立,请你根据下表实验方案,完成空格.
| 实验步骤及操作方法 | 实验现象 | 结 论 |
| a、向装有滤液的烧杯中滴加 硝酸银溶液 | ______ | 假设③成立 |
| b、过滤后,向白色沉淀中加入足量的______. | 白色沉淀部分溶解,且有 ______产生 |
查看习题详情和答案>>
首先将废液进行过滤,得到的滤渣为(1)
【提出问题】滤液的酸碱性有几种情况?
【猜想与假设】小康猜想滤液的酸碱性有3种情况:
猜想①:滤液呈酸性 猜想②;滤液呈中性 猜想③:滤液呈碱性
小强经过思考后认为,猜想(2)
【查阅资料】Ba2+对水源能造成重金属污染.
【实验探究】小健用pH试纸测定滤液的pH=9,说明滤液呈碱性.
【交流与评价】小健、小康分别设计了两个方案,他们都认为自己的方案可以使滤液达到无污染.
小健的方案:向滤液中滴加稀盐酸,边加边测试,直到溶液pH=7
小康的方案:向滤液中滴加稀硫酸,边加边测试,直到溶液pH=7
请你评价小健、小康的方案是否正确,并说明理由.
| 正确或错误 | 理 由 | |
小健的方案 |
错误 错误 |
滴加稀盐酸,只能和碱性物质反应,但不能和钡离子结合成沉淀,消除钡离子的污染 滴加稀盐酸,只能和碱性物质反应,但不能和钡离子结合成沉淀,消除钡离子的污染 |
小康的方案 |
正确 正确 |
滴加稀硫酸,既除去了废液中的碱使溶液呈现中性,又使钡离子转化成了难溶性的硫酸钡沉淀,实现了绿色排放 滴加稀硫酸,既除去了废液中的碱使溶液呈现中性,又使钡离子转化成了难溶性的硫酸钡沉淀,实现了绿色排放 |
(1)取两支大试管,分别倒入适量的6%、15%的双氧水,再加入等量的MnO2,各收集一小试管气体,发现浓度大的先收集满.该操作过程中合理的排列顺序是(选填序号)
①检验装置的气密性 ②待有连续稳定气泡再排水集气
③将水槽中待收集气体的小试管注满水 ④旋紧连有导管的单孔胶塞
⑤向大试管内倒入适量双氧水再加入少许MnO2粉末
(2)根据表中提供的信息回答:
| 试管编号 | 双氧水质量分数 | 实验操作 | 现象 |
| A | 6% | 加入少许MnO2粉末 | 产生气泡多且快,用带火星的木条悬空伸入试管内,发现火星复燃 |
| B | 6% | 少许CuO粉末 | 产生气泡较多但没有A快,用带火星的木条悬空伸入试管内,火星仅发亮但不复燃 |
| C | 6% | 将试管浸入约80℃的热水中 | 一开始溶液内有少量细小气泡浮起,放入热水后,溶液内气泡明显增多.这时将带火星的木条悬空伸入试管内,却不能复燃 |
比较A、C两试管的现象,分析两者现象差异的根本原因是
“化学反应条件的控制是实验的灵魂”。某校化学兴趣小组在老师指导下,进行了“影响双氧水分解因素”的实验。请你帮助回答下列问题。
(1)取两支大试管,分别倒入适量的6%、15%的双氧水,再加入等量的MnO2,各收集一小试管气体,发现浓度大的先收集满。该操作过程中合理的排列顺序是:
(选填序号)。
① 检验装置气密性
② 待有连续稳定气泡再排水集气
③ 将水槽中待收集气体的小试管注满水
④ 旋紧连有导管的单孔胶塞
⑤ 向大试管内倒入适量双氧水再加入少许MnO2粉末
(2)用试管进行排水集气时,主要出现了如下图所示的4种操作,其中合理的是
(此小题为不定项选择填空,多选、错选不给分)。
 |
(3)取a、b两支试管加入等体积6%的双氧水,再分别加入少许MnO2粉末、CuO粉末,发现a中比b中产生气泡多且快。随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃。由此得出影响双氧水分解的因素是 。
(4)再取一支试管倒入适量6%的双氧水,仔细观察溶液内有少量细小气泡升起;然后将该支试管浸入约80℃的热水中,溶液内气泡明显增多。这时将带火星的木条悬空伸入试管内,却不能复燃。试对比第(3)小题a中火星复燃的现象,分析两者现象差异的根本原因是 。
查看习题详情和答案>>