网址:http://m.1010jiajiao.com/timu3_id_242364[举报]
在一定温度和压强下,将装有N2和NO2混合气体的试管倒立在水中,经足够长的时间后,试管内气体的体积缩小为原体积的![]() ,则原混合气体中氮气与二氧化氮的体积比是 ( )
,则原混合气体中氮气与二氧化氮的体积比是 ( )
A.2:3 B.3:2 C.3:5 D.5:3
查看习题详情和答案>>(1)已知::![]()
![]()
![]()
则![]() 的
的![]() =__________________________。
=__________________________。
(2)工业合成氮的反应为![]() 。在一定温度下,将一定量的N
。在一定温度下,将一定量的N![]() 和H
和H![]() 通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是___________________。
①增大压强 ②增大反应物的浓度
③使用催化荆 ④降低温度
(3) 工业合成氨的反应为![]() 。设在容积为2.0L的密闭容器中充入
。设在容积为2.0L的密闭容器中充入![]() 和
和![]() .反应在一定条件下达到平衡时,NH
.反应在一定条件下达到平衡时,NH![]() 的物质的量分数(NH
的物质的量分数(NH![]() 的物质的量与反应体系中总的物质的量之比)为
的物质的量与反应体系中总的物质的量之比)为![]() 。计算
。计算
①该条件下N![]() 的平衡转化率为______________;
的平衡转化率为______________;
②该条下反应![]() 的平衡常数为_____________。
的平衡常数为_____________。
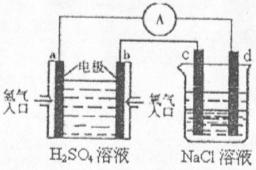
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒。NaCI溶液的体积为500m1)
①a极为________极,电极反应式__________________________;
c极为________极,电极反应式__________________________
②右图装置中,当b极上消耗的O![]() 在标准状况下的体积为280ml时,则NaCl溶液
在标准状况下的体积为280ml时,则NaCl溶液
的PH为_________ (假设反应前后溶液体积不变,且NaCl溶液足量)
①2N2O5(g)?4NO2(g)+O2(g);△H>0
②2NO2(g)?2NO(g)+O2(g);△H>0

若达平衡时,c(NO2)=0.4mol?L-1,c(O2)=1.3mol?L-1.
(1)反应②中NO2的转化率为
(2)将密闭容器内的氮氧化物用水吸收完全转化为硝酸,是否还需要通入氧气?
(3)如图1装置可用于制备N2O5,则N2O5在电解池的
材料2:选择性催化还原法(SCR)脱除NOx具有较高的效率,是目前工业中应用最广泛的工艺.在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
③18NO(g)+2C3H6(g)?9N2(g)+6CO2(g)+6H2O(g);△H1
④18NO2(g)+4C3H6(g)?9N2(g)+12CO2(g)+12H2O(g);△H2
探究丙烯还原NOx有关问题:
(4)在容积相同的两组均为多个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生可逆反应③或④,并分别在t秒时测定其中NOx转化率,绘得如如图2所示,下列说法不正确的是
A.反应③的△Hl<0;反应④的△H2<0
B.反应③中,当反应消耗2molNO的同时生成了1molN2,说明该反应已达平衡
C.该催化剂在450℃活性最大
D.对于反应③,其他条件不变时,增大压强,NO转化率增大
E.相同条件下,NO2的转化率要比NO的大.
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol
N2O5,达到平衡时,气体的压强为原来的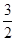 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。

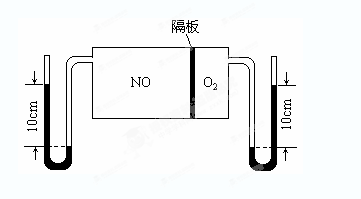
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。
查看习题详情和答案>>