网址:http://m.1010jiajiao.com/timu3_id_241005[举报]
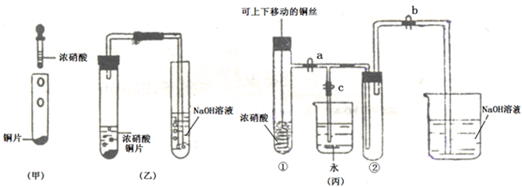
(1)写出铜和浓硝酸反应的化学方程式
(2)与甲装置相比,乙装置的优点是
(3)欲使NO2气体充满试管②,应先
A.颜色 B.平均摩尔质量 C.质量 D.压强E.密度
(4)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是
(5)试管②中的NO2和水充分反应后,所得溶液物质的量浓度最大值是
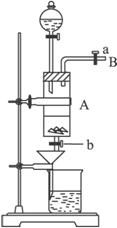
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是__________________________________________________________________。
(2)烧杯内放过量稀HNO3的原因是_______________________________________________,
发生反应的离子方程式是________________________________________________。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是________
____________________________________________________________________。
(4)利用这个装置进行实验,你认为该实验存在的缺点可能有:
__________________________,__________________________。(写两条即可)
(5)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是_____________。(填序号)①适量氯气 ②适量过氧化氢和稀盐酸 ③高锰酸钾酸性溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是__________________________
_____________________________________________________________________。
查看习题详情和答案>>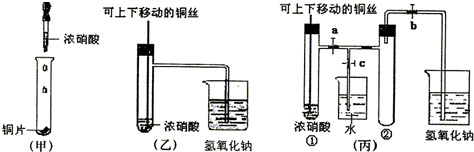
(1)写出铜和浓硝酸反应的离子方程式
(2)和甲装置相比,乙装置的优点有
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置,做实验时先关闭弹簧夹
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是

(1)写出铜和浓硝酸反应的化学方程式:
____________________________________________________________________。
(2)和甲装置相比,乙装置的优点有
____________________________________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置,做实验时先关闭弹簧夹___________,再打开弹簧夹___________,才能使NO2气体充满②试管。
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作?______________________。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是___________(气体体积按标准状况计算)。
查看习题详情和答案>>