网址:http://m.1010jiajiao.com/timu3_id_240952[举报]
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
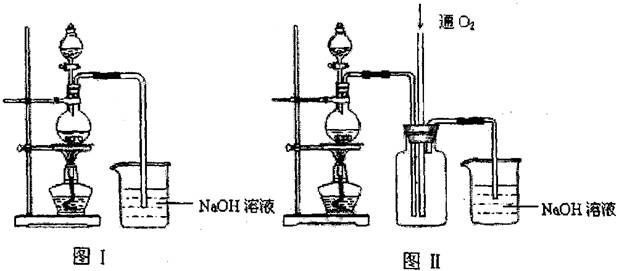
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
|
5.4g |
7.9g |
6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是 。
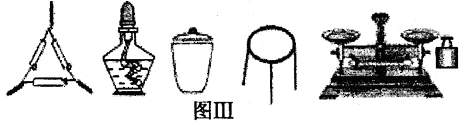
②判断样品已恒重的方法是 。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
|
学校 姓名 考号 班级
|
|
……………………………………………密………………………………………封……………………………………………….线………………………………………………….
|
查看习题详情和答案>>
| 时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1 | 4 | 0 | 0 |
| 4 | 0.25 | 3.25 | 0.75 | 0.75 |
| 6 | n1 | n2 | n3 | n4 |
| 8 | n1 | n2 | n3 | n4 |
| t | 0.15 | 3.15 | 0.85 | 0.85 |
| A、前4min,用CO表示的化学反应速率为v(CO)=0.25mol/(L?min) |
| B、反应在第4min时处于化学平衡状态 |
| C、8分钟时,混合气体中CO2的体积分数为16% |
| D、t分钟时,反应所处的温度高于850℃ |
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;假设B:
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中加KSCN溶液 | 溶液为血红色 溶液为血红色 |
固体物质中有FeCl3 |
| ②向R溶液中滴加酸性KMnO4溶液 | KMnO4溶液紫色不褪色 KMnO4溶液紫色不褪色 |
固体物质中不含FeCl2 |
(3)写出向R溶液中滴加少量KSCN溶液的离子方程式:
(4)R溶液常作印刷电路铜板的腐蚀剂,写出该反应的离子方程式:
| 金属离子 | Ksp | pH(10-1 mol?L-1) | pH(10-5 mol?L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| Ca2+ | 4.0×10-5 | 12.3 | 14.3 |
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准.
①Cr2O72-转变为Cr3+的离子方程式为

②pH对废水中Cr2O72-去除率的影响如右图.你认为电解过程中溶液的pH取值在
[注:去除率(%)=[(c0-c)/co]×100%,式中:co-理前废水中Cr2O72-的浓度,c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用.例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=
(1)该反应中氧化剂是
(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
下列表示该反应过程的示意图正确的是
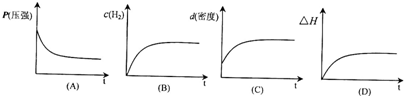
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
| [HCOO-] | [HCOOH]?[OH-] |
A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是