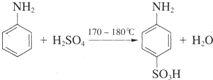
题目内容
(2010?江苏二模)随着工业的迅速发展,产生的废水对水体的污染也日趋严重.通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法.下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5 mol?L-1时通常认为该离子沉淀完全).
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol?L-1.为除去其中的Fe3+,回收铜,需控制的pH范围是
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准.
①Cr2O72-转变为Cr3+的离子方程式为
②pH对废水中Cr2O72-去除率的影响如右图.你认为电解过程中溶液的pH取值在
[注:去除率(%)=[(c0-c)/co]×100%,式中:co-理前废水中Cr2O72-的浓度,c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用.例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=
| 金属离子 | Ksp | pH(10-1 mol?L-1) | pH(10-5 mol?L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
| Ca2+ | 4.0×10-5 | 12.3 | 14.3 |
3.7≤pH<4.7
3.7≤pH<4.7
.(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准.
①Cr2O72-转变为Cr3+的离子方程式为
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.
②pH对废水中Cr2O72-去除率的影响如右图.你认为电解过程中溶液的pH取值在
5~6
5~6
范围内对降低废水中的铬含量最有利,请说明理由:pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小
pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小
.[注:去除率(%)=[(c0-c)/co]×100%,式中:co-理前废水中Cr2O72-的浓度,c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用.例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=
3.25×103
3.25×103
(写数值).[已知Ksp(CaSO4)=9.1x10-6,Ksp(CaCO3)=2.8×10-9].分析:(1)根据题目信息要要完全除去其中的Fe3+,不沉淀Cu2+,则3.7≤pH<4.7;
(2)①Cr2O72-转变为Cr3+,亚铁离子具有还原性,转变为Fe3+,
②由图可知:pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小;
(3)CaSO4和碳酸钠反应转化为CaCO3的离子方程式为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),其平衡常数K=
=
;
(2)①Cr2O72-转变为Cr3+,亚铁离子具有还原性,转变为Fe3+,
②由图可知:pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小;
(3)CaSO4和碳酸钠反应转化为CaCO3的离子方程式为:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),其平衡常数K=
| C(SO4 2-) |
| C(CO3 2-) |
| Ksp(CaSO4) |
| Ksp(CaCO3) |
解答:解:(1)要完全除去其中的Fe3+,不沉淀Cu2+,则3.7≤pH<4.7;故答案为:3.7≤pH<4.7;
(2)①Cr2O72-转变为Cr3+,亚铁离子具有还原性,转变为Fe3+,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小,所以溶液的pH取值在5~6范围内对降低废水中的铬含量最有利,
故答案为:5~6;pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小;
(3)平衡常数K=
=
=
=3.25×103,故答案为:3.25×103;
(2)①Cr2O72-转变为Cr3+,亚铁离子具有还原性,转变为Fe3+,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小,所以溶液的pH取值在5~6范围内对降低废水中的铬含量最有利,
故答案为:5~6;pH越小,Cr2O72-的去除率越大,但难形成Cr(OH)3沉淀从废水中分离;pH越大,Cr2O72-的去除率越小;
(3)平衡常数K=
| C(SO4 2-) |
| C(CO3 2-) |
| Ksp(CaSO4) |
| Ksp(CaCO3) |
| 9.1x10 -6 |
| 2.8×10 -9 |
点评:本题考查溶液的除杂、氧化还原反应、化学平衡常数的含义与计算,是一道综合题,难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目