摘要:归纳比较.讲究方法. 对一种具体的物质来说.其知识链的基本构成如下: 结构-性质-制法.用途.保存.鉴别.分离.除杂.提纯等.其关系为: 制法 鉴别 用途 分离除杂等 保存 提纯 我们要学会以物质的性质为中心.以物质的结构为基础的化学思维方法.物质为什么有这样的性质?要从物质的结构上找原因.物质为什么有这样的用途?它的保存.鉴别.分离等为什么能采用这样的方法?要从物质具有的物理性质和化学性质上去找根据.去理解问题.这是学习元素化合物知识的基本方法.也是形成化学思维的前提条件. 例如:学习钠在自然界中的存在和性质.要同钠的性质联系起来.钠是一种化学性质极活泼的金属.所以钠自然只能以化合态形式存在.而且主要是以钠盐的形式存在,通过钠跟氧气反应.就会联想到可用钠来制取过氧化钠,钠具有很强的还原性.联想到钠是一种强还原剂,此外.金属钠具有导电性.导热性.就可能联想到钠可用于原子反应堆和电光源上等. 总之.从物质的性质入手.推导出物质的存在和用途.这是掌握物质的存在和用途的最佳方法.根据这样的思路进行思考和学习.会起到事半功倍的效果.
网址:http://m.1010jiajiao.com/timu3_id_237923[举报]
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)E的简单离子的结构示意图为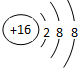
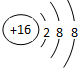 ;
;
(2)D在周期表中的位置为
(3)B和C简单离子的半径大小为
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
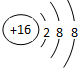
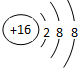
(2)D在周期表中的位置为
第三周期IIIA族
第三周期IIIA族
;(3)B和C简单离子的半径大小为
O2->Na+
O2->Na+
;(用离子符号和“>”、“=”或“<”表示)(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
ad
ad
(填序号);a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
Na2O、Al2O3
Na2O、Al2O3
(写化学式,下同),既含离子键又含共价键的是Na2O2
Na2O2
.归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低.
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的三种溶液:a.CH3COONa b NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka:醋酸根水解常数为Kb;水的离子积为Kw:则三者关系为:Ka?Kb=Kw
⑥反应A(g)═2B(g)△H,若正反应的活化能为Ea kJ?mol-1,逆反应的活化能 为Eb kJ?mol-1,
则△H=(Ea-EB)kJ,mol-1上述归纳正确的是( )
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低.
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的三种溶液:a.CH3COONa b NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka:醋酸根水解常数为Kb;水的离子积为Kw:则三者关系为:Ka?Kb=Kw
⑥反应A(g)═2B(g)△H,若正反应的活化能为Ea kJ?mol-1,逆反应的活化能 为Eb kJ?mol-1,
则△H=(Ea-EB)kJ,mol-1上述归纳正确的是( )
| A、全部 | B、③④⑤⑥ | C、②④⑤⑥ | D、①②④⑤ |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka?Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka?Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变.
| A、①④ | B、①②④ | C、①②④⑤ | D、①②③④ |