网址:http://m.1010jiajiao.com/timu3_id_237416[举报]
(8分) t℃时,将 2molSO2和 1molO2通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ,此反应放热. 2min 时反应达到化学平衡,此时测得反应物O2还剩余 0.8mol,请填写下列空白:
2SO3(g) ,此反应放热. 2min 时反应达到化学平衡,此时测得反应物O2还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为 ;平衡时,SO2 转化率为 .
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是
A.向容器中通入O2 B.扩大容器的体积
C.使用正催化剂 D.升高温度 E.向容器中通入氦气
(8分) t℃时,将 2molSO2
和 1molO2
通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ,此反应放热. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,此反应放热. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为 ;平衡时,SO2 转化率为 .
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是
A.向容器中通入O2 B.扩大容器的体积
C.使用正催化剂 D.升高温度 E.向容器中通入氦气
查看习题详情和答案>>
 2SO3(g) ,此反应放热. 2min 时反应达到化学平衡,此时测得反应物O2还剩余 0.8mol,请填写下列空白:
2SO3(g) ,此反应放热. 2min 时反应达到化学平衡,此时测得反应物O2还剩余 0.8mol,请填写下列空白:(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为 ;平衡时,SO2 转化率为 .
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是
A.向容器中通入O2 B.扩大容器的体积
C.使用正催化剂 D.升高温度 E.向容器中通入氦气
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为 ;
T1 T2 (选填“>”、“<”或“=”),理由是 。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-)之比为 。
该溶液中c(OH—)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 (用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4 查看习题详情和答案>>
2SO2(g)+O2(g)
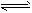 2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物
2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时SO2转化率为_________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)_______________。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是__________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为_____________。