题目内容
工业制硫酸的过程中利用反应2SO2(g)+O2(g) 2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g)+Q (Q>0),将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
(1)写出该可逆反应的化学平衡常数表达式 ;
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2发生反应,下列说法中,正确的是 (填编号)。
a.若反应速率υ正(O2)=2υ逆(SO3),则可以说明该可逆反应已达到平衡状态
b.保持温度和容器体积不变,充入2 mol N2,化学反应速率加快
c.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
d.平衡后升高温度,平衡常数K增大
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
(3)实验1从开始到反应达到化学平衡时,υ(SO2)表示的反应速率为 ;
T1 T2 (选填“>”、“<”或“=”),理由是 。尾气SO2用NaOH溶液吸收后会生成Na2SO3。现有常温下0.1mol/LNa2SO3溶液,实验测定其pH约为8,完成下列问题:
(4)该溶液中c(Na+)与 c(OH-)之比为 。
该溶液中c(OH—)= c(H+)+ + (用溶液中所含微粒的浓度表示)。
(5)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是 (用编号排序)
A.Na2SO3 B.Ba(NO3)2 C.Na2S D.酸性KMnO4
(1)K=[SO3]2/([SO2]2[O2])
(2)c
(3)0.2mol/(L· min)(2分)>; 反应放热,温度升高平衡向左移动,反应物转化率低
(4)2×105 ; (2分)c(HSO3-)+2c(H2SO3)
(5)B>C =D>A
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知其平衡常数表达式为K=[SO3]2/([SO2]2[O2])。
(2)a、反应速率υ正(O2)=2υ逆(SO3)不能满足反应速率之比是相应的化学计量数之比,因此不能说明该可逆反应已达到平衡状态,a不正确;b、保持温度和容器体积不变,充入2 mol N2,物质的浓度不变,则化学反应速率不变,b不正确;c、平衡后移动活塞压缩气体,压强增大平衡向正反应方向移动,所以平衡时SO2、O2的百分含量减小,SO3的百分含量增大,c正确;D、正方应是放热反应,则平衡后升高温度,平衡向逆反应方向移动,所以平衡常数K减小,d不正确,答案选c。
(3)根据表中数据可知平衡时氧气的物质的量减少2mol-0.8mol=1.2mol,则根据反应式可知生成三氧化硫2.4mol,其浓度为2.4mol÷2=1.2mol/L,所以用三氧化硫表示的反应速率为1.2mol/L÷6min=0.2mol/(L· min)。X=4mol-1.2mol×2=1.6mol,而在t2时二氧化硫的平衡量是0.4mol,这说明t2时二氧化硫的转化率高。由于正方应是放热反应,所以降低温度才有利于SO2的转化,所以T1>T2。
(4)pH约为8,因此溶液中c(OH-)=10-6mol/L,溶液中钠离子浓度为0.2mol/L,所以该溶液中c(Na+)与c(OH-)之比为0.2mol/L ÷10-6mol/L =2×105 。根据质子守恒可知该溶液中c(OH—)=c(H+)+ c(HSO3-)+2c(H2SO3)。
(5)A、Na2CO3吸收二氧化硫发生的反应为:Na2CO3+2SO2+H2O=2NaHSO3+CO2↑,1molNa2CO3最多吸收二氧化硫2mol;B、Ba(NO3)2 吸收二氧化硫反应化学方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2H2SO4+2NO↑:1molBa(NO3)2最多吸收二氧化硫3mol;C、Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;D、酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;计算分析吸收二氧化硫理论吸收量由多到少的顺序是B>C=D>A,故答案为:B>C=D>A。
考点:考查可逆反应的有关判断、计算以及溶液中离子浓度关系的有关判断与计算

(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
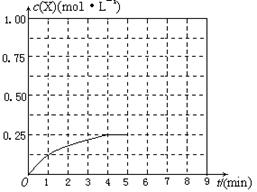
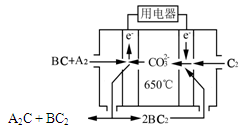
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
(15分)已知2A(g)+B(g)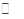 2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),?H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol B B. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol B D. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如图:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如图:
下列说法正确的是
| A.反应在前50 s 的平均速率v(PCl3)=0.0032 mol·L-1·s-1 |
| B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
| D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+
2NH3+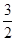 O2
O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol·h-1。
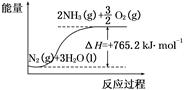
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是 。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:①该条件下的平衡常数为 ;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量 (填“>”“<”或“=”)92.4 kJ。

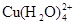 (aq) +4Cl-(aq)
(aq) +4Cl-(aq)
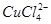 (aq) +4H2O(l)
(aq) +4H2O(l)
 2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。
2SO3(g)。SO2的起始浓度是0.4 mol·L-1,O2的起始浓度是1 mol·L-1,当SO2的转化率为80%时,反应达到平衡状态。 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ。原因是 _____________________________