摘要:27.对于反应2S02(g)+02(g)2SO3(g).当其他条件不变时.只改变一个反应条件.将生成的S03的反应速率的变化填入下表空格内(填“增大 .“减小 或“不变 ). 编号 改变的条件 生成SO3的速率 ① 升高温度 ② 降低温度 ③ 增大氧气的浓度 ④ 使用催化剂 ⑤ 压缩体积
网址:http://m.1010jiajiao.com/timu3_id_237317[举报]
对于反应2S02+02 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
查看习题详情和答案>>
 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).| 编号 | 改变的条件 | 生成SO3一的速率 |
| ① | 升高温度 | 增大 增大 |
| ② | 降低温度 | 减小 减小 |
| ③ | 增大氧气的浓度 | 增大 增大 |
| ④ | 使用催化剂 | 增大 增大 |
| ⑤ | 压缩体积 | 增大 增大 |
(1)已知拆开1mol H-H键、1mol I-I键、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成1mol HI需要
(2)下列五种物质中①Ne ②H2O ③NH3 ④KOH ⑤Na2O,只存在共价键的是
(3)按要求填空:
①推测Si、N 间氢化物的稳定性;
②C:
③3416S2-微粒中的质子数是
(4)对于反应2S02+02 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
查看习题详情和答案>>
放出
放出
(填“放出”或“吸收”)5.5
5.5
kJ的热量.氢气、碘单质和碘化氢三种分子最稳定的是H2
H2
.(2)下列五种物质中①Ne ②H2O ③NH3 ④KOH ⑤Na2O,只存在共价键的是
②③
②③
,只存在离子键的是⑤
⑤
,既存在共价键又存在离子键的是④
④
,不存在化学键的是①
①
.(填写序号)(3)按要求填空:
①推测Si、N 间氢化物的稳定性;
NH3
NH3
>SiH4
SiH4
(填化学式) ②C:
二
二
周期IVA
IVA
族;③3416S2-微粒中的质子数是
16
16
,中子数是18
18
,核外电子数是18
18
.(4)对于反应2S02+02
 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
(6分)对于反应2S02+02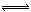 2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大氧气的浓度 | |
| ④ | 使用催化剂 | |
| ⑤ | 压缩体积 | |
| ⑥ | 恒容下充人Ne | |
(6分)对于反应2S02+02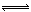 2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g)当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
|
编号 |
改变的条件 |
生成SO3的速率 |
|
① |
升高温度 |
|
|
② |
降低温度 |
|
|
③ |
增大氧气的浓度 |
|
|
④ |
使用催化剂 |
|
|
⑤ |
压缩体积 |
|
|
⑥ |
恒容下充人Ne |
|
查看习题详情和答案>>
(12分)(1)某温度时,在4 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式为 。
反应开始至2min,Z的平均反应速率为 。若X、Y、Z均为气体,反应达平衡时:此时体系的压强是开始时的 倍。
(2)对于反应2S02+02![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 |
|
② | 降低温度 |
|
③ | 增大氧气的浓度 |
|
④ | 使用催化剂(正) |
|
⑤ | 压缩体积 |
|
⑥ | 减少S02的浓度 |
|
查看习题详情和答案>>