摘要:现有部分短周期元素的性质或原子结构如下表: (1)元素X的一种同位素可测定文物年代.这种同位素的符号是 .元素Z的离子结构示意图为 . (2)元素Y与氢元素形成一种离子 则检测溶液中存 在该离子的方法是 . (3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: . (4)元素X与元素Y相比.非金属性较强的是 .下列表述中证明这一事实的是 . a.常温下X的单质和Y的单质状态不同 b.Y的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物的酸性强 c.X与Y形成的化合物中X元素呈正价态 (5)探寻物质的性质差异性是学习的重要方法之一.X.Y.Z三种元素的单质中化学性质明显不同于其他两种单质的是 .理由 . [解析]根据X元素的核外电子排布特点可知是碳元素,Y的氢化物水溶液显碱性且单质是双原子分子.则Y必是氮元素,Z元素是第三周期简单离子中半径最小的.由于同周期元素的离子半径分成两种情况.阳离子半径依次减小.阴离子半径也是依次减小.但是阴离子半径明显比阳离子半径大很多.因此Z元素必定是第三周期的金属元素铝.其他内容可据题目要求逐一解决. 答案:(1) 中加入NaOH溶液后加热.能产生使湿润的红色石蕊试纸变蓝的气体.说明溶液中存在该离子.反之.不存在该离子 3+OH- ==== +2H2O Al 具有金属性
网址:http://m.1010jiajiao.com/timu3_id_235086[举报]
现有部分短周期元素的性质或原子结构如下表:
(1)元素T的气态氢化物的分子式是
(2)元素Y与氢元素形成一种含有10个电子的常见阳离子的化学式是
(3)元素Z与元素T相比,非金属性较强的是
A.常温下Z的单质和T的单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其它三种酸的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | K层和M层上电子数之和等于L层上电数子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
H2S
H2S
.元素X的一种同位素可测定文物年代,这种同位素的符号是146C
146C
.(2)元素Y与氢元素形成一种含有10个电子的常见阳离子的化学式是
NH4+
NH4+
,该微粒含有的化学键类型是共价键
共价键
(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列表述中能证明这一事实的是B
B
A.常温下Z的单质和T的单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其它三种酸的是
H2CO3
H2CO3
(用化学式表示),理由是弱酸(其他答案合理也可)
弱酸(其他答案合理也可)
.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素Z的气态氢化物的电子式
 (用相关元素符号表示),该氢化物VESPR模型是
(用相关元素符号表示),该氢化物VESPR模型是
(2)Y元素的价电子排布式
(3)元素T与氯元素相比,非金属性较强的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的氢化物的沸点高于HCl.
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |


四面体型
四面体型
.(2)Y元素的价电子排布式
3s23p1
3s23p1
.(3)元素T与氯元素相比,非金属性较强的是
F
F
(用元素符号表示),下列表述中能证明这一事实的是c
c
.a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的氢化物的沸点高于HCl.
现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH+4,写出该微粒的电子式
 (用元素符号表示)
(用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
614C
614C
.(2)元素Y与氢元素形成一种离子YH+4,写出该微粒的电子式


(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列表述中能证明这一事实的是b
b
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是
碳酸
碳酸
,理由是碳酸属于弱酸
碳酸属于弱酸
.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是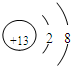
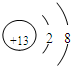 .
.
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为
(4)元素X与元素Y相比,非金属性较强的是
a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b. X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态.
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
O3
O3
,元素Z的离子结构示意图为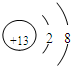
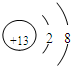
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论
取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
取少量溶液(或待测液)于试管中,滴加适量浓NaOH溶液后加热,将湿润的红色石蕊试纸沾在玻璃棒上靠近试管口部,若试纸变蓝,说明溶液中存在该离子,反之,不存在该离子
.(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)元素X与元素Y相比,非金属性较强的是
O
O
(用元素符号表示),下列表述中能证明这一事实的是a,b,c
a,b,c
.a.Y的氢化物可在纯X2中燃烧生成X的氢化物和Y2
b. X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态.
现有部分短周期元素的性质或原子结构如下表:
(1)元素T的原子最外层共有
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层p电子数比s电子数多2个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
6
6
种不同运动状态的电子.写出X原子的电子排布式1s22s22p2
1s22s22p2
.(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
用元素符号表示),下列表述中能证明这一事实的是b
b
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
H2CO3
H2CO3
,理由是H2CO3为弱酸性或非氧化性酸
H2CO3为弱酸性或非氧化性酸
.