题目内容
现有部分短周期元素的性质或原子结构如下表:
(1)写出元素Z的气态氢化物的电子式
 (用相关元素符号表示),该氢化物VESPR模型是
(用相关元素符号表示),该氢化物VESPR模型是
(2)Y元素的价电子排布式
(3)元素T与氯元素相比,非金属性较强的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的氢化物的沸点高于HCl.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |


四面体型
四面体型
.(2)Y元素的价电子排布式
3s23p1
3s23p1
.(3)元素T与氯元素相比,非金属性较强的是
F
F
(用元素符号表示),下列表述中能证明这一事实的是c
c
.a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的氢化物的沸点高于HCl.
分析:根据单质能与水剧烈反应,所得溶液呈弱酸性,则T为F元素,
根据X的L层p电子数比s电子数多2个,核外电子排布为1S22S22P4,则X为O元素,
根据第三周期元素的简单离子中半径最小的离子为Al 3+,则Y为Al元素,
根据Z的L层有三个未成对电子,核外电子排布为1S22S22P3,则Z为N元素,以此解答该题.
根据X的L层p电子数比s电子数多2个,核外电子排布为1S22S22P4,则X为O元素,
根据第三周期元素的简单离子中半径最小的离子为Al 3+,则Y为Al元素,
根据Z的L层有三个未成对电子,核外电子排布为1S22S22P3,则Z为N元素,以此解答该题.
解答:解:(1)Z的氢化物为NH3,电子式为 ,氢化物VESPR模型为四面体型,
,氢化物VESPR模型为四面体型,
故答案为: ;四面体型;
;四面体型;
(2)Al元素的价电子排布式为3s23p1,故答案为:3s23p1;
(3)F的非金属性比Cl元素强,可根据得电子能力判断,氯与F形成的化合物中氯元素呈正价态,说明F易得到电子,则说明F的非金属性强,故答案为:F;c;
 ,氢化物VESPR模型为四面体型,
,氢化物VESPR模型为四面体型,故答案为:
 ;四面体型;
;四面体型;(2)Al元素的价电子排布式为3s23p1,故答案为:3s23p1;
(3)F的非金属性比Cl元素强,可根据得电子能力判断,氯与F形成的化合物中氯元素呈正价态,说明F易得到电子,则说明F的非金属性强,故答案为:F;c;
点评:本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.

练习册系列答案
相关题目


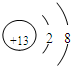




 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-