题目内容
现有部分短周期元素的性质或原子结构如下表:
(1)元素T的气态氢化物的分子式是
(2)元素Y与氢元素形成一种含有10个电子的常见阳离子的化学式是
(3)元素Z与元素T相比,非金属性较强的是
A.常温下Z的单质和T的单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其它三种酸的是
| 元素编号 | 元素性质或原子结构 |
| T | K层和M层上电子数之和等于L层上电数子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
H2S
H2S
.元素X的一种同位素可测定文物年代,这种同位素的符号是146C
146C
.(2)元素Y与氢元素形成一种含有10个电子的常见阳离子的化学式是
NH4+
NH4+
,该微粒含有的化学键类型是共价键
共价键
(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列表述中能证明这一事实的是B
B
A.常温下Z的单质和T的单质状态不同
B.Z的氢化物比T的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其它三种酸的是
H2CO3
H2CO3
(用化学式表示),理由是弱酸(其他答案合理也可)
弱酸(其他答案合理也可)
.分析:先根据元素的原子结构与性质判断T、X、Y、Z四种元素,然后根据各题要求分析解答.
解答:解:T:K层和M层上电子数之和等于L层上电数子,所以,次外层是K层,最外层是M层,K层排2个电子,L层排8个电子,M层排6个电子,所以是硫元素;
X:最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,所以,次外层是K层,最外层是L层,K层排2个电子,L层排4个电子,所以是碳元素;
Y:常温下单质为双原子分子,其氢化物水溶液呈碱性,所以是氮元素;
Z:由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素.
(1)元素T是硫,所有气态氢化物的分子式是H2S,因146C可用来测定文物年代,故答案为:H2S、146C;
(2)N与氢元素形成一种含有10个电子的常见阳离子的是NH4+,非金属原子与非金属原子之间形成共价键,
故答案为:NH4+;共价键
(3)根据同周期非金属性质的变化规律及比较非金属性的方法来分析,Cl的非金属性比S元素强,Z的氢化物比T的氢化物稳定则说明Z的非金属性强,故答案为:Cl;B;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物中H2CO3,其他酸为强酸,故答案为:H2CO3;弱酸(其他答案合理也可).
X:最外层电子数是次外层电子数的2倍,最外层电子数不超过8个,所以,次外层是K层,最外层是L层,K层排2个电子,L层排4个电子,所以是碳元素;
Y:常温下单质为双原子分子,其氢化物水溶液呈碱性,所以是氮元素;
Z:由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素.
(1)元素T是硫,所有气态氢化物的分子式是H2S,因146C可用来测定文物年代,故答案为:H2S、146C;
(2)N与氢元素形成一种含有10个电子的常见阳离子的是NH4+,非金属原子与非金属原子之间形成共价键,
故答案为:NH4+;共价键
(3)根据同周期非金属性质的变化规律及比较非金属性的方法来分析,Cl的非金属性比S元素强,Z的氢化物比T的氢化物稳定则说明Z的非金属性强,故答案为:Cl;B;
(4)T、X、Y、Z四种元素的最高价氧化物的水化物中H2CO3,其他酸为强酸,故答案为:H2CO3;弱酸(其他答案合理也可).
点评:本题考查学生利用结构、性质的关系来推断元素,然后利用元素化合物知识来解答,习题难度不大,应注重归纳非金属性强弱的比较方法来解答此类习题.

练习册系列答案
相关题目


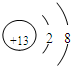




 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-