摘要:26.蒸发溶剂 (3)80
网址:http://m.1010jiajiao.com/timu3_id_23346[举报]
(2013?朝阳区一模)海水蕴藏着丰富的资源.
(1)海水中溶剂 是
(2)从海水中提取粗盐一般可采用
(3)如图1是特殊情况下使用的应急净水器.利用该净水器将2000g含氯化钠3%的海水暴晒4小时,收集到500g可饮用水,此时剩余海水中氯化钠的质量分数为
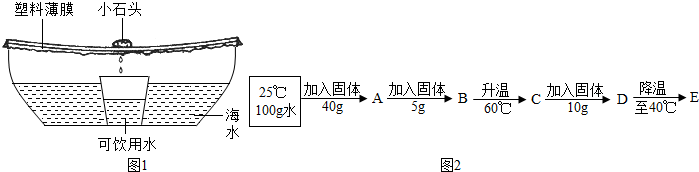
(4)利用氯化钠制备碳酸钠的同时可以得到氯化铵,下表为氯化铵的溶解度:
①向100g水中不断加入氯化铵固体或改变温度,得到图2相应的溶液A~E.
溶液D是
②将盛有溶液E的小烧杯放入盛有水的大烧杯中,向大烧杯内加入NaOH固体,小烧杯内的固体溶解,原因是
查看习题详情和答案>>
(1)海水中溶剂 是
水
水
.(2)从海水中提取粗盐一般可采用
蒸发溶剂
蒸发溶剂
方法.(3)如图1是特殊情况下使用的应急净水器.利用该净水器将2000g含氯化钠3%的海水暴晒4小时,收集到500g可饮用水,此时剩余海水中氯化钠的质量分数为
4%
4%
.
(4)利用氯化钠制备碳酸钠的同时可以得到氯化铵,下表为氯化铵的溶解度:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
溶液D是
不饱和
不饱和
(填“饱和”或“不饱和”)溶液,溶液E中析出晶体9.2
9.2
g.②将盛有溶液E的小烧杯放入盛有水的大烧杯中,向大烧杯内加入NaOH固体,小烧杯内的固体溶解,原因是
氢氧化钠固体溶于水放热,使得氯化铵的溶解度增大而溶解
氢氧化钠固体溶于水放热,使得氯化铵的溶解度增大而溶解
.生活处处皆化学.
(1)生活中的燃烧
①着火点比较:蜂窝煤
②用水灭火的原理是
(2)金属在生活中用途广泛
①如图1下列生活用品,主要是由金属材料制成的是
图3
②用铁锅烹饪食物时,会有少量铁屑在胃部转化为可被吸收的Fe2+,反应的化学方程式为
③用铝箔包装药物,主要利用了铝的
④铜具有很好的
(3)生活中的水和溶液
①处理自然水时,常用的混凝剂是
②欲配制500mL 0.9%的生理盐水(密度为1.0g/mL),需要NaCl的质量为
③图2是净化河水的简易装置,下列说法正确的是
A.净化后的水是纯净物 B.此装置能对水杀菌消毒
C.此装置能把硬水变为软水 D.活性炭能吸附水中的色素及异味
④KNO3可用作配制无土栽培营养液,下表提供了KNO3在不同温度时的溶解度:
a.从上表可总结出KNO3的溶解度随温度变化的趋势是
b.20℃时,将20gKNO3加入50g水中充分溶解,所得溶液的质量为
c.现有60℃时的KNO3饱和溶液210g,降温至20℃,会析出KNO3
(4)食品包装学问大
①我区特产--嘶马羊耳采用真空包装,延长了食品的保质期,原理是
②将N2充入包装袋内做保护气,是因为N2的化学性质
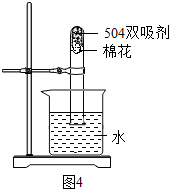
③图3是“504双吸剂”的标签,请问答下列问题:
a.其中至少含有
b.取少量双吸剂加入蒸馏水中,振荡后静置,测得上层清液的pH=9,若用pH试纸测定,具体操作是
c.为测定此双吸剂的使用效果,取足量双吸剂做了如图4所示的实验,一段时间后,进入试管中水的体积
d.部分失效的双吸剂中,有红棕色固体,其主要是
e.此双吸剂中,NaCl的作用可能是
查看习题详情和答案>>
(1)生活中的燃烧
①着火点比较:蜂窝煤
>
>
小木条(填“>”、“<”或“=”).生煤炉过程中,不断扇入空气目的是与氧气充分接触
与氧气充分接触
,煤不完全燃烧产生一种有毒气体的化学式是CO
CO
;②用水灭火的原理是
水蒸发吸热,使温度降低到着火点以下
水蒸发吸热,使温度降低到着火点以下
,新型水成膜泡沫灭火剂扑灭油类火灾时,析出的液体和泡沫在油面上铺展形成一层水膜,进而灭火,原理是隔绝氧气
隔绝氧气
.(2)金属在生活中用途广泛
①如图1下列生活用品,主要是由金属材料制成的是
AC
AC
;
| 品名:504双吸剂 成分:铁粉、NaCl、炭粉CaO等 |

②用铁锅烹饪食物时,会有少量铁屑在胃部转化为可被吸收的Fe2+,反应的化学方程式为
Fe+2HCl═FeCl2+H2↑
Fe+2HCl═FeCl2+H2↑
,是置换
置换
反应(填基本反应类型).③用铝箔包装药物,主要利用了铝的
延展
延展
性;④铜具有很好的
导电
导电
性,故可作导线.近代湿法冶金的先驱是指Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
(填化学方程式),铜和空气中的O2、H2O及CO2
CO2
会生成铜锈[Cu2(OH)2CO3],反应的化学方程式是2Cu+O2+H2O+CO2═Cu2(OH)2CO3
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
.(3)生活中的水和溶液
①处理自然水时,常用的混凝剂是
明矾
明矾
(填名称).二氧化氯是一种新型的消毒剂,其化学式为ClO2
ClO2
;②欲配制500mL 0.9%的生理盐水(密度为1.0g/mL),需要NaCl的质量为
4.5
4.5
g;配制过程中,玻璃棒的作用是搅拌,加快溶解
搅拌,加快溶解
,称量NaCl时,若将砝码放在左盘(1g以下用游码),其他操作均正确,则所配溶液中溶质质量分数将<
<
0.9%(填“>”、“<”或“=”)③图2是净化河水的简易装置,下列说法正确的是
D
D
;A.净化后的水是纯净物 B.此装置能对水杀菌消毒
C.此装置能把硬水变为软水 D.活性炭能吸附水中的色素及异味
④KNO3可用作配制无土栽培营养液,下表提供了KNO3在不同温度时的溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
随温度升高而增加
随温度升高而增加
;b.20℃时,将20gKNO3加入50g水中充分溶解,所得溶液的质量为
65.8
65.8
g;c.现有60℃时的KNO3饱和溶液210g,降温至20℃,会析出KNO3
78.4
78.4
g;(4)食品包装学问大
①我区特产--嘶马羊耳采用真空包装,延长了食品的保质期,原理是
隔绝氧气,杜绝缓慢氧化
隔绝氧气,杜绝缓慢氧化
;②将N2充入包装袋内做保护气,是因为N2的化学性质
稳定
稳定
(填“活泼”或“稳定”);③图3是“504双吸剂”的标签,请问答下列问题:
a.其中至少含有
2
2
种单质;b.取少量双吸剂加入蒸馏水中,振荡后静置,测得上层清液的pH=9,若用pH试纸测定,具体操作是
用玻璃棒蘸取一滴上层清液,滴在pH试纸上,待颜色不再变化时和标准比色卡对照,读数
用玻璃棒蘸取一滴上层清液,滴在pH试纸上,待颜色不再变化时和标准比色卡对照,读数
.通入CO2后,上层清液变浑浊,写出上述变化的化学方程式H2O+CaO═Ca(OH)2
H2O+CaO═Ca(OH)2
、Ca(OH)2+CO2═CaCO3↓+H2O
Ca(OH)2+CO2═CaCO3↓+H2O
;c.为测定此双吸剂的使用效果,取足量双吸剂做了如图4所示的实验,一段时间后,进入试管中水的体积
>
>
21%(填“>”、“<”或“=”),理由是此双吸剂能同时吸收空气中的O2和CO2,也可吸收H2O
此双吸剂能同时吸收空气中的O2和CO2,也可吸收H2O
;d.部分失效的双吸剂中,有红棕色固体,其主要是
氧化铁
氧化铁
;e.此双吸剂中,NaCl的作用可能是
加快双吸剂中铁粉吸收O2的速率
加快双吸剂中铁粉吸收O2的速率
.下表是氯化钠、氯化铵在不同温度下的溶解度(单位:g)
(1)20℃时,氯化铵的溶解度是
(2)40℃时,向两只分别盛有42gNaCl和NH4Cl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是
(3)将上述(2)中的不饱和溶液变成饱和溶液,可采用
(4)将100g25%的NaCl溶液稀释为10%的NaCl溶液,需要加水
查看习题详情和答案>>
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | |
| 物质的溶解度 | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
37.2
37.2
g.(2)40℃时,向两只分别盛有42gNaCl和NH4Cl固体的烧杯中,各加入100g水,充分溶解后,能形成饱和溶液的物质是
NaCl
NaCl
(填化学式).(3)将上述(2)中的不饱和溶液变成饱和溶液,可采用
降低温度(或蒸发溶剂)
降低温度(或蒸发溶剂)
方法.(4)将100g25%的NaCl溶液稀释为10%的NaCl溶液,需要加水
150
150
g.(2013?宿城区模拟)下表是氯化钠和硝酸钾在不同温度下的溶解度数据,根据数据回答问题.
(1)由数据知,氯化钠属于
(2)从NaCl的饱和溶液中提取NaCl,应采用的方法是
Ⅰ.冷却结晶Ⅱ.蒸发溶剂Ⅲ.过滤
(3)20℃时,把17克氯化钠和17克硝酸钾分别放入50克水中,能形成饱和溶液的是
(4)根据数据分析,氯化钠和硝酸钾的溶解度相等的温度范围是
I.0℃~20℃Ⅱ.20℃~40℃Ⅲ.40℃~60℃Ⅳ. 60℃~80℃
(5)将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温(20℃),析出的晶体是
查看习题详情和答案>>
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 (g/100g水) |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
易溶
易溶
(填易溶、可溶、微溶或难溶)物质.溶解度受温度影响变化比较大的物质是KNO3
KNO3
(填“NaCl”或“KNO3”).(2)从NaCl的饱和溶液中提取NaCl,应采用的方法是
Ⅱ
Ⅱ
(填序号).Ⅰ.冷却结晶Ⅱ.蒸发溶剂Ⅲ.过滤
(3)20℃时,把17克氯化钠和17克硝酸钾分别放入50克水中,能形成饱和溶液的是
KNO3
KNO3
(填“NaCl”或“KNO3”),其饱和溶液的质量是65.8g
65.8g
克.为使其变为不饱和溶液,可采用的一种方法是加水
加水
.(4)根据数据分析,氯化钠和硝酸钾的溶解度相等的温度范围是
Ⅱ
Ⅱ
(填序号).I.0℃~20℃Ⅱ.20℃~40℃Ⅲ.40℃~60℃Ⅳ. 60℃~80℃
(5)将硝酸钾和氯化钠的热混合溶液(两者均己达到饱和)冷却至室温(20℃),析出的晶体是
NaCl、KNO3
NaCl、KNO3
.下列数据是氯化钠和氯化铵固体在不同温度时的溶解度。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g NaCl | 35.7 | 36.0 | 36.6 | 37.6 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.5 | 77.3 |

1.医疗上,氯化钠常用于配制0.9%的生理盐水,生理盐水中溶质为________。
2.从海水中提取食盐通常采取晾晒海水的方法,这是因为随温度升高氯化钠的溶解度变化________(填“大”或“小”)。
3.20℃时,向100 g水中加入25 g氯化钠,充分溶解后,溶液中溶质质量分数为 ________。
4.现有200 g溶质质量分数为10%的氯化钠溶液,若使溶液的溶质质量分数增加一
倍,应该蒸发掉 ________g水。
5.30℃时,向两个分别盛有相同质量的氯化钠和氯化铵的烧杯中,各加入100 g水,充分溶解后,恢复至30℃,其结果如右图所示。有关下列说法中,正确的是________(填字母序号)。
A.烧杯②中溶液是不饱和溶液
B.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
C.若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
D.将得到的烧杯②中溶液降温至0℃时,溶液中溶质质量分数一定减小
查看习题详情和答案>>