摘要:在100℃时.将0.200molN2O4气体充入2L抽空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格: 时间(s) 浓度 0 20 40 60 80 100 C(N2O4) 0.100 c1 0.050 c3 a b C(NO2) 0.000 0.060 c2 0.120 0.120 0.120 试完成: (1)该反应的化学方程式为 表中c2 c3. a b(填“ > .“< .“ = ) (2)20s时N2O4的浓度c1= mol/L, 在0s-20s时间段内.N2O4的平均反应速率为 molL-1s-1. (3)若在相同情况下最初向该容器的NO2气体.要达到上述同样的平衡状态.NO2的起始浓度是 mol/L.
网址:http://m.1010jiajiao.com/timu3_id_233077[举报]
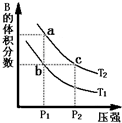 对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.
对于反应A(g)?2B(g)△H>0,在温度为T1、T2时,平衡体系中B的体积分数随压强变化的曲线如图所示.回答下列各题.(1)根据曲线图,分析下列说法正确的是
BC
BC
(填字母).A.a、c两点的反应速率:a>c
B.由状态b到状态a,可以通过加热的方法
C.b、c两点A气体的转化率相等
(2)上述反应在密闭容器(定容)中进行,达到平衡状态的标志是
BE
BE
(填字母).A.单位时间内生成n mol A的同时分解2n molB
B.两种气体的体积分数不再改变
C.v正(A)=2v逆(B)
D.混合气体的密度不再发生变化
E.混合气体的压强不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol?L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度
>
>
0.1mol?L-1(填“>”、“<”或“=”).(4)在100℃时,将0.40mol的B气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
0.000875mol/(L?s)
0.000875mol/(L?s)
;②上表中n3
=
=
n4(填“>”、“<”或“=”),反应A(g)?2B(g)在100℃时的平衡常数K的值为0.36
0.36
,升高温度后,反应2B(g)?A(g)的平衡常数K的值减小
减小
(填“增大”、“减小”或“不变”);③若在相同情况下最初向该容器中充入的是A气体,要达到上述同样的平衡状态,A气体的起始浓度为
0.1
0.1
mol?L-1. 在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
0.15
0.15
mol/(L?min).(2)此条件下该反应的化学平衡常数的值约为
2.8
2.8
(保留两位有效数字).(3)若达到平衡后,降低温度,气体颜色会变浅,则该反应的平衡常数将
增大
增大
(填“增大”、“减小”或“不变”).(4)若在相同情况下最初向该容器中充入的是N2O4气体,要达到初始数据表中同样的平衡状态,N2O4的起始浓度是
0.10mol/L
0.10mol/L
;假设在80s时达到平衡,请在图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.

(5)计算(4)中条件下达到平衡后N2O4的转化率
60%
60%
. 在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
0.0025mol?L-1?min-1
0.0025mol?L-1?min-1
mol?L-1?min-1.(2)n3
=
=
n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8
2.8
;(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
0.1mol/L
0.1mol/L
mol/L.(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为
60%
60%
,混合气体的平均摩尔质量为57.5
57.5
g.mol-1.(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2
 N2O4的平衡常数将
N2O4的平衡常数将减小
减小
(填“增大”、“减小”或“不变”)(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2
 N2O4将
N2O4将向左移动
向左移动
.(填“向左移动”、“向右移动”或“不移动”).(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因
缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
. 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题:(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
75%
75%
.(2)在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
=
=
n4(填“>”或“<”或“=”),该反应的平衡常数的值为2.8
2.8
;②若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
0.1
0.1
mol?L-1,假设在80s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.(3)以甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的正极反应式
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
试填空:
(1)达到平衡时N2O4的转化率为
(2)20s的四氧化二氮的浓度c1=
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是
查看习题详情和答案>>
| 时间/s 浓度mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol?L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)达到平衡时N2O4的转化率为
60
60
%,表中c2>
>
c3,a=
=
b (选填“>”“<”“=”).(2)20s的四氧化二氮的浓度c1=
0.070
0.070
mol?L-1,在0s~20s内四氧化二氮的平均反应速率为0.0015
0.0015
mol?(L?s)-1.(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是
0.200
0.200
mol?L-1.