题目内容
 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题:(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
75%
75%
.(2)在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
=
=
n4(填“>”或“<”或“=”),该反应的平衡常数的值为2.8
2.8
;②若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
0.1
0.1
mol?L-1,假设在80s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.(3)以甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的正极反应式
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.分析:(1)令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算.
(2)①反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,计算出平衡时各物质的浓度,根据平衡常数的计算公式计算.
②根据等效平衡计算出平衡时四氧化二氮的物质的量浓度,以此画出图象,注意N2O4、NO2的起始浓度、平衡浓度,NO2的浓度变化与N2O4的浓度变化关系.
(3)甲醇为原料的燃料电池,甲醇为负极,氧气是正极,根据两极的放电规律来回答.
(2)①反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,计算出平衡时各物质的浓度,根据平衡常数的计算公式计算.
②根据等效平衡计算出平衡时四氧化二氮的物质的量浓度,以此画出图象,注意N2O4、NO2的起始浓度、平衡浓度,NO2的浓度变化与N2O4的浓度变化关系.
(3)甲醇为原料的燃料电池,甲醇为负极,氧气是正极,根据两极的放电规律来回答.
解答:解:(1)对于反应 CO(g)+H2O(g)  H2(g)+CO2(g),
H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
=9,解得c=0.015
所以CO的转化率为
×100%=75%.
故答案为:75%.
(2)①由表可知,60s时反应达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4,
根据反应方程式计算:
2NO2 N2O4
N2O4
初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,
所以该温度下该反应平衡常数k=
=2.8
故答案为:=; 2.8
②根据反应 2NO2 N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
=0.1mol/L.
根据反应 2NO2 N2O4可知,NO2的浓度随时间变化为N2O4的浓度变化2倍.从放入N2O4到平衡时需要80s,初始加入的N2O4的物质的量浓度为0.1mol/L,平衡时N2O4的物质的量浓度为0.04mol/L,NO2的物质的量浓度为2×(0.1mol/L-0.04mol/L)=0.12mol/L,图象可取起点、20s、80s等几个点用平滑曲线来连接.
N2O4可知,NO2的浓度随时间变化为N2O4的浓度变化2倍.从放入N2O4到平衡时需要80s,初始加入的N2O4的物质的量浓度为0.1mol/L,平衡时N2O4的物质的量浓度为0.04mol/L,NO2的物质的量浓度为2×(0.1mol/L-0.04mol/L)=0.12mol/L,图象可取起点、20s、80s等几个点用平滑曲线来连接.
故答案为: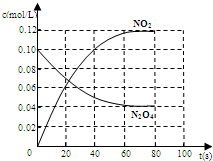
(3)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子得还原反应,氢氧化钠为电解质,在碱性环境下,氧气的放电情况为:O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.
 H2(g)+CO2(g),
H2(g)+CO2(g),开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以
| c×c |
| (0.02-c)×(0.02-c) |
所以CO的转化率为
| 0.015mol/L |
| 0.02mol/L |
故答案为:75%.
(2)①由表可知,60s时反应达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4,
根据反应方程式计算:
2NO2
 N2O4
N2O4初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N2O4)=0.04mol/L,c(NO2)=0.12mol/L,
所以该温度下该反应平衡常数k=
| 0.04 |
| 0.122 |
故答案为:=; 2.8
②根据反应 2NO2
 N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是| 0.2mol |
| 2L |
根据反应 2NO2
 N2O4可知,NO2的浓度随时间变化为N2O4的浓度变化2倍.从放入N2O4到平衡时需要80s,初始加入的N2O4的物质的量浓度为0.1mol/L,平衡时N2O4的物质的量浓度为0.04mol/L,NO2的物质的量浓度为2×(0.1mol/L-0.04mol/L)=0.12mol/L,图象可取起点、20s、80s等几个点用平滑曲线来连接.
N2O4可知,NO2的浓度随时间变化为N2O4的浓度变化2倍.从放入N2O4到平衡时需要80s,初始加入的N2O4的物质的量浓度为0.1mol/L,平衡时N2O4的物质的量浓度为0.04mol/L,NO2的物质的量浓度为2×(0.1mol/L-0.04mol/L)=0.12mol/L,图象可取起点、20s、80s等几个点用平滑曲线来连接.故答案为:

(3)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,氧气是正极,发生得电子得还原反应,氢氧化钠为电解质,在碱性环境下,氧气的放电情况为:O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.
点评:本题考查化学反应速率、平衡移动相关计算、原电池等,题目较为综合,涉及多方面的知识,难度中等,本题中注意把握等效平衡的解题应用.

练习册系列答案
相关题目
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
 (2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(2013?闸北区二模)如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: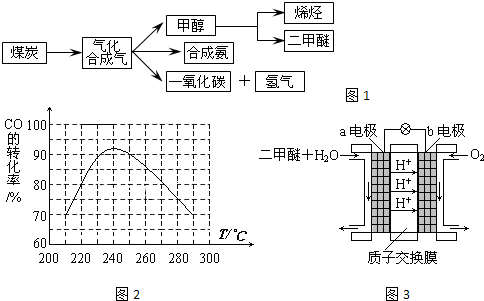
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题: