摘要:用10gNaOH固体配制成0.5mol/LNaOH溶液.所得溶液的体积是( ) A. 0.5ml B. 5ml C. 50ml D. 500ml
网址:http://m.1010jiajiao.com/timu3_id_231356[举报]
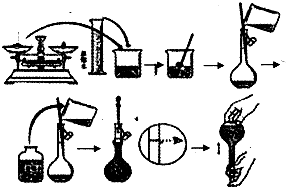 今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液.配制过程如图所示:
今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液.配制过程如图所示:请根据题意回答:
(1)配制该溶液应选用
100mL容量瓶
100mL容量瓶
(填仪器).(2)用小烧杯在托盘天平上称取
2.0g
2.0g
NaOH固体.(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应
重新配制
重新配制
.(4)配制好的溶液
不能
不能
(填“能”或“不能”)长期存放在容量瓶中.(5)以下因素会造成实验结果偏低的是
cd
cd
(填序号)a.容量瓶中原来有少量蒸馏水 b.定容时观察液面俯视
c.忘记洗涤 d.定容时观察液面仰视.
(1)用NaCl固体配制100mL 1.00mol/L NaCl溶液的步骤为:计算;称量;溶解;洗涤;摇匀;装瓶贴签等.其中缺少的步骤名称有
(2)国际上规定,
(3)在水溶液里或
(4)酸、碱、盐在水溶液中发生的离子反应的条件是生成
(5)在化学反应中,如果反应前后元素化合价发生变化,就一定有
(6)离子反应特有的守恒关系为
(7)将
查看习题详情和答案>>
移液、定容
移液、定容
.(2)国际上规定,
0.012kg12C所含碳原子数
0.012kg12C所含碳原子数
叫做阿伏加德罗常数.(3)在水溶液里或
熔融状态
熔融状态
下能够导电的化合物
化合物
叫做电解质.(4)酸、碱、盐在水溶液中发生的离子反应的条件是生成
沉淀、气体或弱电解质
沉淀、气体或弱电解质
,只要具备上述条件之一,反应就能发生.(5)在化学反应中,如果反应前后元素化合价发生变化,就一定有
电子转移
电子转移
;元素化合价升高,该物质发生氧化还原
氧化还原
反应.(6)离子反应特有的守恒关系为
电荷
电荷
守恒;氧化还原反应特有的守恒关系为电子转移
电子转移
守恒.(7)将
饱和氯化铁溶液
饱和氯化铁溶液
滴入沸水
沸水
中可制备氢氧化铁胶体,反应的化学方程式为FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
.某同学欲配制450mL 0.1mol/L的碳酸钠溶液,试根据所学回答下列问题.
(1)若采用5mol/L的碳酸钠溶液配制溶液,需要用到碳酸钠溶液的体积为
(2)若用碳酸钠固体配制,一定会用到的仪器有
A.450ml容量瓶 B.500ml容量瓶 C.量筒 D.胶头滴管
E.烧杯 F.玻璃棒 G.托盘天平
(3)欲准确配制所需溶液,下列称量质量正确的是
A.称Na2CO3 4.8克 B.Na2CO3 5.3克
C.称Na2CO3?10H2O 12.87克 D.称Na2CO3?10H2O 14.30克
(4)若在配溶液的过程中用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的碳酸钠固体
D.重新配制
(5)下列操作可能导致结果偏高的是
A.转移后没有洗涤烧杯
B.定容时俯视
C.定容时仰视
D.称取的Na2CO3 溶液中混有少量Na2CO3?10H2O
E.配溶液前用碳酸钠溶液润洗容量瓶.
查看习题详情和答案>>
(1)若采用5mol/L的碳酸钠溶液配制溶液,需要用到碳酸钠溶液的体积为
10.0
10.0
mL.(2)若用碳酸钠固体配制,一定会用到的仪器有
BDEFG
BDEFG
A.450ml容量瓶 B.500ml容量瓶 C.量筒 D.胶头滴管
E.烧杯 F.玻璃棒 G.托盘天平
(3)欲准确配制所需溶液,下列称量质量正确的是
B
B
A.称Na2CO3 4.8克 B.Na2CO3 5.3克
C.称Na2CO3?10H2O 12.87克 D.称Na2CO3?10H2O 14.30克
(4)若在配溶液的过程中用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是
D
D
(填序号).A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的碳酸钠固体
D.重新配制
(5)下列操作可能导致结果偏高的是
BE
BE
.A.转移后没有洗涤烧杯
B.定容时俯视
C.定容时仰视
D.称取的Na2CO3 溶液中混有少量Na2CO3?10H2O
E.配溶液前用碳酸钠溶液润洗容量瓶.