摘要:下列说法中正确的是 A.原子之间的强烈的相互作用叫化学键 B.离子键一定是金属离子和非金属离子之间通过静电作用形成的化学键 C.离子化合物也可能全部由非金属元素组成 D.两种非金属原子之间能形成离子键
网址:http://m.1010jiajiao.com/timu3_id_220350[举报]
下列说法中正确的是
- A.构成单质分子的微粒一定含有共价键
- B.不同的三种元素组成的化合物中一定含有离子键
- C.化学键指两个或多个原子之间强烈的相互作用
- D.阴、阳离子之间的吸引力和排斥力达平衡时形成离子键
下列说法中正确的是
[ ]
A.构成单质分子的微粒一定含有共价键
B.不同的三种元素组成的化合物中一定含有离子键
C.化学键指两个或多个原子之间强烈的相互作用
D.阴、阳离子之间的吸引力和排斥力达平衡时形成离子键
查看习题详情和答案>>几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | ——- | -3 | -2 | |
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Y、M的单质分别与水反应,Y最剧烈
C.X、Z、R的最高价氧化物的水化物之间可两两相互反应
D.Y的氧化物水化物的酸性一定强于R的的氧化物水化物的酸性 查看习题详情和答案>>
 尿素(
尿素(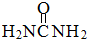 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:Na2B4O7+2CO(NH2)2═4(BN)+Na2O+2CO2↑+4H2O
(1)上述反应物中含有一种元素,其基态原子具有4种不同能量电子,写出该基态原子的电子排布式
(2)元素B、C、O、N第一电离能由大到小的顺序
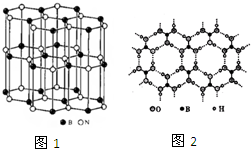
(3)某硼氮化合物的结构与石墨相似(如图1),俗称“白石墨”.
①晶体中B、N原子的杂化方式分别是
②白石墨不能导电,原因是B、N原子之间的π键电子被
③写出“白石墨”的一种用途
(4)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)].结构测定知,1mol该配合物中含有6NA个配位键.形成配位键时,提供孤对电子的原子是
(5)由硼砂可以制取硼酸,硼酸(H3BO3)是一种片层状结构白色晶体,层内的“H3BO3”微粒之间通过氢键相连(如图2),则下列有关说法中不正确的是
A.硼酸晶体属于分子晶体
B.H3BO3晶体中有氢键,因此硼酸分子较稳定
C.分子中各原子最外层均为8电子稳定结构
D.1mol H3BO3晶体中含有3mol氢键.