网址:http://m.1010jiajiao.com/timu3_id_218638[举报]
铝及铝合金经过阳极氧化,铝表面能生成几十微米的较厚的氧化铝膜。

Ⅰ.某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面;
b.用水冲洗经有机物擦洗的铝片,浸入60~70 ℃的2 mol·L-1的NaOH溶液中,以除去原有的氧化膜,约1 min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解;
c.阳极氧化,以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照如图连接电解装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。
试回答下列问题:
(1)用苯和酒精擦拭铝片的目的:_______________________________,
氢氧化钠溶液处理铝片时反应的离子方程式是____________________________________。
(2)阳极的电极反应式为______________________________。
(3)下列有关说法正确的是________(填字母代号)。
A.电解时电子从电源负极→导线→铅极,铝极→导线→电源正极
B.在电解过程中,H+向阳极移动,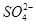 向阴极移动
向阴极移动
C.电解过程中溶液的pH基本不变
D.电解时,铝片为阳极,被氧化
Ⅱ.另一小组针对铝表面保护膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期用来盛放和腌制咸菜。究其原因,该小组设计了一个实验以探究其中的原因。他们的实验过程如下:
|
实验 |
|
|
|
编号 |
实验过程 |
实验现象 |
|
1 |
取一小片铝片于试管中,加入1.0 mol·L-1的盐酸2 mL |
30秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
2 |
取一小片铝片于试管中,加入0.5 mol·L-1的硫酸2 mL |
55秒时开始有少量气泡,然后产生气泡的速率加快,最后铝片消失 |
|
3 |
取一小片铝片于试管中,加入氯化铜稀溶液 |
3分钟左右表面产生少量气泡,且铝表面析出一些红色固体 |
|
4 |
取一小片铝片于试管中,加入硫酸铜稀溶液 |
一直没有明显的变化 |
你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是________________________________________________________________________。
根据该实验现象,你认为铝制容器不能长期盛放和腌制咸菜的原因是________________________________________________________________________。
查看习题详情和答案>>

Ⅰ.铁矿石中含氧量的测定
①按如图组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略):
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为
(2)测得反应后装置B增重1.35g,则铁矿石中氧的百分含量为
(3)若将H2换成CO,则还需补充
Ⅱ.铁矿石中含铁量的测定
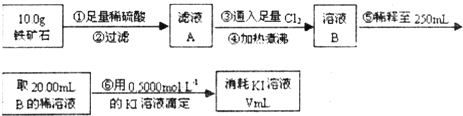
(4)步骤④中煮沸的作用是
(5)步骤⑤中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)下列有关步骤⑥的操作中说法正确的是
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(7)若滴定过程中消耗0.5000mol?L-1的KI溶液20.00mL,则铁矿石中铁的百分含量为
Ⅲ.(8)由I、II可以推算出该铁矿石中铁的氧化物的化学式
(18分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
(3)若将H2换成CO,则还需补充 装置。
Ⅱ.铁矿石中含铁量的测定
(1)溶液A中铁元素可能的存在形式 ;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为: 。
a.酸性KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.氯水
(2)步骤④中煮沸的作用是 。
(3)步骤⑤中用到的玻璃仪器有: 。
(4)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定时,右手控制滴定管,左手摇动锥形瓶
f.滴定过程中,眼睛注视滴定管中液面变化
g.滴定结束后,待液面稳定后再读数
(5)若滴定过程中消耗0.5000mol·L?1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定

① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
(3)若将H2换成CO,则还需补充 装置。
Ⅱ.铁矿石中含铁量的测定

(1)溶液A中铁元素可能的存在形式 ;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为: 。
a.酸性KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.氯水
(2)步骤④中煮沸的作用是 。
(3)步骤⑤中用到的玻璃仪器有: 。
(4)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定时,右手控制滴定管,左手摇动锥形瓶
f.滴定过程中,眼睛注视滴定管中液面变化
g.滴定结束后,待液面稳定后再读数
(5)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看习题详情和答案>>铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定

① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
(3)若将H2换成CO,则还需补充 装置。
Ⅱ.铁矿石中含铁量的测定

(1)溶液A中铁元素可能的存在形式 ;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为: 。
a.酸性KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.氯水
(2)步骤④中煮沸的作用是 。
(3)步骤⑤中用到的玻璃仪器有: 。
(4)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定时,右手控制滴定管,左手摇动锥形瓶
f.滴定过程中,眼睛注视滴定管中液面变化
g.滴定结束后,待液面稳定后再读数
(5)若滴定过程中消耗0.5000mol·L??1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
查看习题详情和答案>>