题目内容
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定

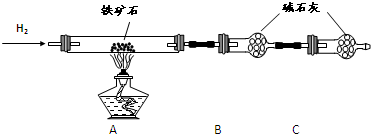
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
(3)若将H2换成CO,则还需补充 装置。
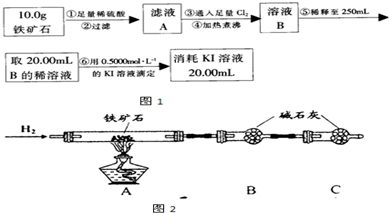
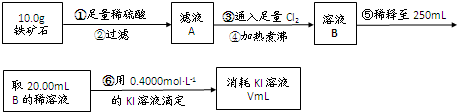
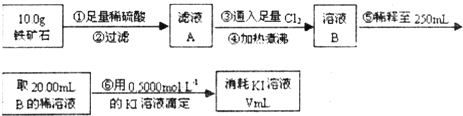
Ⅱ.铁矿石中含铁量的测定

(1)溶液A中铁元素可能的存在形式 ;请从以下试剂中选择最佳试剂用最简单的实验验证A中铁元素的存在形式,试剂为: 。
a.酸性KMnO4溶液 b.NaOH溶液 c.KSCN溶液 d.氯水
(2)步骤④中煮沸的作用是 。
(3)步骤⑤中用到的玻璃仪器有: 。
(4)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定时,右手控制滴定管,左手摇动锥形瓶
f.滴定过程中,眼睛注视滴定管中液面变化
g.滴定结束后,待液面稳定后再读数
(5)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
Ⅰ.(1)防止空气中的水蒸气和CO2进入B中,影响测定结果。
(2)24%(1分) (3)尾气处理
Ⅱ.(1)Fe2+、Fe3+; a c (2)赶走溶液中溶解的过量的Cl2
(3)烧杯、玻璃棒、250mL容量瓶、滴管 (4)dg (5)70%(1分)
Ⅲ.Fe5O6
Ⅰ.氧元素的百分含量为: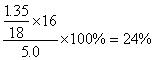
Ⅱ.(1)由于铁矿石中铁的价态不确定,所以与酸反应后溶液中可能存在Fe2+、Fe3+;Fe2+可以与KMnO4溶液反应,使KMnO4溶液褪色;Fe3+与SCN−反应使溶液变为血红色;若使用NaOH,若Fe3+多、Fe2+少,则沉淀呈红褐色,Fe(OH)2的颜色已被掩盖,从而无法判断Fe2+是否存在。
(2)通入过量的Cl2是为了将铁元素全部变为Fe3+,但是为了防止过量的氯气与KI反应,使测定结果偏高,所以要将溶液煮沸赶走溶液中溶解的过量的Cl2。
(4)a.碘水、Fe3+均为黄色,滴定过程中颜色无明显变化,故a错。
b.2Fe3+ + 2I− = 2Fe2+ + I2,滴定一开始就生成I2,使淀粉溶液变蓝,无法指示终点。正确的指示剂应该为KSCN,颜色变化为血红色变为无色。故b错。
c.滴定管用蒸馏水洗涤后必需用待装液润洗后才能装液。故c错。
e.滴定时,左手控制滴定管,右手摇动锥形瓶。故e错。
f.滴定过程中,眼睛注视锥形瓶中溶液颜色变化。故f错。
(5)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式可知,c(Fe3+)=c(KI)=0.5mol·L−1,所以铁元素的百分含量为:
![]()
Ⅲ.因为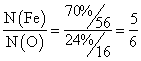 ,所以铁矿石中铁的氧化物的化学式为Fe5O6
,所以铁矿石中铁的氧化物的化学式为Fe5O6

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案