摘要:3.下列各类反应一定是氧化还原反应的是 A.化合反应 B.分解反应 C.置换反应 D.复分解反应
网址:http://m.1010jiajiao.com/timu3_id_217897[举报]
A、B、C、D、E五种短周期元素,其原子序数依次增大。其中,C与E可形成原子个数比分别为1:1和1:2的两种离子化合物;A与E同主族;B与E的原子序数之和等于C与D的原子序数之和。请回答下列问题:
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是 ;
(2)由A、B、C、E四种元素组成的一种在日常生活中具有重要用途的酸式盐,溶于水后得到的溶液中存在 种平衡体系,该溶液中各种离子间的电荷守恒关系式为 ;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式 ;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中,在正极上发生反应的物质是 , 负极上的电极反应式为 。
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是 ;
(2)由A、B、C、E四种元素组成的一种在日常生活中具有重要用途的酸式盐,溶于水后得到的溶液中存在 种平衡体系,该溶液中各种离子间的电荷守恒关系式为 ;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式 ;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中,在正极上发生反应的物质是 , 负极上的电极反应式为 。
(分)A、B、C、D、E五种短周期元素,其原子序数依次增大。其中,C与E可形成原子个数比分别为1:1和1:2的两种离子化合物;A与E同主族;B与E的原子序数之和等于C与D的原子序数之和。请回答下列问题:
(1)C与E形成的一种化合物可与BC2发生氧化还原反应,该化合物中含有的化学键类型是 ;
(2)由A、B、C、E四种元素组成的一种在日常生活中具有重要用途的酸式盐,溶于水后得到的溶液中存在 种平衡体系,该溶液中各种离子间的电荷守恒关系式为 ;
(3)等物质的量的D单质与E的氢氧化物在一定条件下恰好完全反应,生成一种盐、水和一种气体,该反应的化学方程式 ;
(4)以金属Pt为电极,以E的氢氧化物的溶液作电解质溶液,将A、C的单质分别通入到两个电极上,可以构成原电池。该电池中,在正极上发生反应的物质是 , 负极上的电极反应式为 。
查看习题详情和答案>>(2009?泰州模拟)高纯超净特种气体主要用于制造半导体器件、化合物半导体、激光器、光导纤维、太阳能电池等.超纯硅化氢制备方法如下:(已知:常温下SiH4难溶于水,与稀硫酸不反应,乙醚沸点34.6℃)
①由下列两种方法制得SiH4
方法一:Mg2Si+4NH4Cl
SiH4+2MgCl2+4NH3
方法二:LiAlH4+SiCl4
SiH4+AlCl3+LiCl
②除去SiH4中混有的杂质气体
请回答下列问题:
(1)对方法一的理解,有同学认为是NH4+水解产生H+,Mg2Si与H+反应生成SiH4,你认为该观点是否正确?并简述理由
(2)将方法二的固体产物溶于水,只有一种物质能促进水的电离,则NaOH、Mg(OH)2、LiOH碱性由强到弱的顺序为
(3)两种方法制得的SiH4中均含有少量杂质,有同学提出用下列方法除去SiH4中的杂质,其中肯定不可行是
a.用稀硫酸洗气 b.高温使杂质分解 c.低温分馏
(4)甲、乙、丙三同学在讨论SiH4制备方法的化学反应类型时发表如下观点,你认为正确的是
a.甲同学认为两个反应均为氧化还原反应
b.乙同学认为两个反应中只有一个属于氧化还原反应
c.丙同学认为要判断是否属于氧化还原反应,还需要知道SiH4中各元素具体的化合价.
查看习题详情和答案>>
①由下列两种方法制得SiH4
方法一:Mg2Si+4NH4Cl
| 液氨 |
方法二:LiAlH4+SiCl4
| C2H5OC2H5 |
②除去SiH4中混有的杂质气体
请回答下列问题:
(1)对方法一的理解,有同学认为是NH4+水解产生H+,Mg2Si与H+反应生成SiH4,你认为该观点是否正确?并简述理由
不正确,因为该反应在液氨中进行,非水体系,不会水解
不正确,因为该反应在液氨中进行,非水体系,不会水解
.(2)将方法二的固体产物溶于水,只有一种物质能促进水的电离,则NaOH、Mg(OH)2、LiOH碱性由强到弱的顺序为
NaOH>LiOH>Mg(OH)2
NaOH>LiOH>Mg(OH)2
.(3)两种方法制得的SiH4中均含有少量杂质,有同学提出用下列方法除去SiH4中的杂质,其中肯定不可行是
b
b
.a.用稀硫酸洗气 b.高温使杂质分解 c.低温分馏
(4)甲、乙、丙三同学在讨论SiH4制备方法的化学反应类型时发表如下观点,你认为正确的是
bc
bc
.a.甲同学认为两个反应均为氧化还原反应
b.乙同学认为两个反应中只有一个属于氧化还原反应
c.丙同学认为要判断是否属于氧化还原反应,还需要知道SiH4中各元素具体的化合价.
(2012?开封二模)[选修一物质结构与性质]同一周期(短周期)各元素形成单质的沸点变化如图1所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见表.

(1)A原子核外共有
(2)B的单质在空气中燃烧的主要产物是白色的
(3)已知下列数据:
①、Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ/mol
②、2C(s)+
O2(g)=C2O3(s)△H=-1675.7kJ/mol
则C的单质和FeO反应的热化学方程式为
(4)元素D的气态氢化物分子为
(5)G的最高价氧化物水化物的酸根离子的立体构型是
(6)元素H的钠盐晶胞结构如图2所示,每个Na+周围与之距离最近的Na+的个数为
(7)解释上表中氟化物熔点差异的原因:
查看习题详情和答案>>

| 氟化物 | AF | BF2 | DF4 |
| 熔点/K | 1266 | 1534 | 183 |
11
11
种不同运动状态的电子,4
4
种不同能级的电子.(2)B的单质在空气中燃烧的主要产物是白色的
MgO
MgO
,还生成少量的Mg3N2
Mg3N2
(填化学式);(3)已知下列数据:
①、Fe(s)+
| 1 |
| 2 |
②、2C(s)+
| 3 |
| 2 |
则C的单质和FeO反应的热化学方程式为
2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol
2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol
.(4)元素D的气态氢化物分子为
非极性
非极性
分子(填“极性”或“非极性”).D的电负性比E的小
小
(填“大”或“小”).在D、E、G、H四种元素形成的氢化物中,热稳定性最大的是HCl
HCl
(填化学式).(5)G的最高价氧化物水化物的酸根离子的立体构型是
正四面体
正四面体
,其中G原子的杂化轨道类型是sp3
sp3
.(6)元素H的钠盐晶胞结构如图2所示,每个Na+周围与之距离最近的Na+的个数为
12
12
.(7)解释上表中氟化物熔点差异的原因:
NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;MgF2的晶格能比NaF的晶格能大,故MgF2的熔点比NaF高
NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;MgF2的晶格能比NaF的晶格能大,故MgF2的熔点比NaF高
.能源是人类社会发展的基础,地球上最基本的能源是太阳能,生物质能来源于植物及其加工产品所贮存的能量,化石燃料蕴藏的能量也来自远古时期生物体所吸收利用的太阳能.
(1)在当代人们的生活中,你所知道的利用太阳能辐射加热物体的方式有
(2)在生物质能的利用过程中,可以制得重要的有机物乙醇.某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的组成元素的确定、分子式的确定、分子结构的确定.
(Ⅰ)他们决定用分析乙醇燃烧的产物来确定乙醇中含有C、H两种元素,简要说明他们的实验操作方法和现象:
①证明含有氢元素的实验操作方法和现象是
②证明含有碳元素的实验操作方法和现象是
(Ⅱ)用分析燃烧产物来证实乙醇中还含有氧元素时,需要取得一些实验数据,这些数据应该是
实验中他们可能会用到下列装置,请你将必需的相关装置的序号按从左到右排出合理的顺序(→表示气体的流向):
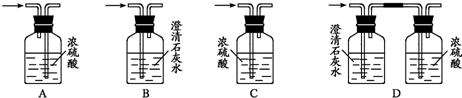
(Ⅲ)为确定乙醇的分子式,除(Ⅱ)中需要取得的数据外,你认为还是否需要测定乙醇的相对分子质量呢?
(Ⅳ)为确定乙醇的分子结构,他们先测定一定量无水乙醇和金属钠反应生成氢气的体积,选用了如下图所示的仪器装置(有的仪器配有双孔橡皮塞).则
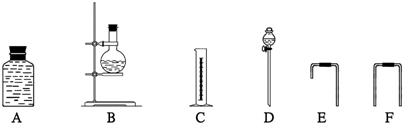
①这些仪器装置的合理的连接顺序是
②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是
(3)开发新能源以缓解石油等的短缺引起的能源危机是一个重要课题.据报道,某地近年建设了一个年生产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量.已知生产酒精的方法有如下三种(用化学方程式表示):
方法一:CH2=CH2+H2O
CH3CH2OH
方法二:CH3-CH2Br+H2O
CH3CH2OH+HBr
方法三:(C6H10O5)n(淀粉)+n H2O
n C6H12O6(葡萄糖)
C6H12O6(葡萄糖)
2C2H5OH+2CO2↑
综合地看,你认为这三种方法中,较好的是
A.方法一 B.方法二 C.方法三
你认为该工厂生产工业酒精用的是
查看习题详情和答案>>
(1)在当代人们的生活中,你所知道的利用太阳能辐射加热物体的方式有
地膜、大棚、温室、太阳能热水器等
地膜、大棚、温室、太阳能热水器等
(任举三例).(2)在生物质能的利用过程中,可以制得重要的有机物乙醇.某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的组成元素的确定、分子式的确定、分子结构的确定.
(Ⅰ)他们决定用分析乙醇燃烧的产物来确定乙醇中含有C、H两种元素,简要说明他们的实验操作方法和现象:
①证明含有氢元素的实验操作方法和现象是
用一干燥的小烧杯倒置在乙醇燃烧火焰上方,烧杯内壁有水珠生成
用一干燥的小烧杯倒置在乙醇燃烧火焰上方,烧杯内壁有水珠生成
.②证明含有碳元素的实验操作方法和现象是
将内壁用澄清石灰水润湿的小烧杯倒置在火焰上方,石灰水变浑浊
将内壁用澄清石灰水润湿的小烧杯倒置在火焰上方,石灰水变浑浊
.(Ⅱ)用分析燃烧产物来证实乙醇中还含有氧元素时,需要取得一些实验数据,这些数据应该是
乙醇、二氧化碳及水三种物质的质量
乙醇、二氧化碳及水三种物质的质量
.实验中他们可能会用到下列装置,请你将必需的相关装置的序号按从左到右排出合理的顺序(→表示气体的流向):
CD或CB
CD或CB
.
(Ⅲ)为确定乙醇的分子式,除(Ⅱ)中需要取得的数据外,你认为还是否需要测定乙醇的相对分子质量呢?
不需要
不需要
.(Ⅳ)为确定乙醇的分子结构,他们先测定一定量无水乙醇和金属钠反应生成氢气的体积,选用了如下图所示的仪器装置(有的仪器配有双孔橡皮塞).则

①这些仪器装置的合理的连接顺序是
D
D
接B
B
接E
E
接A
A
接F
F
接C
C
(填代表各部分仪器装置的大写字母).②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是
根据Na与乙醇反应生成的H2的量判断出只有一个H与其他H原子处于不同的特殊位置.从而进一步确定其结构为C2H5OH而非CH3-O-CH3
根据Na与乙醇反应生成的H2的量判断出只有一个H与其他H原子处于不同的特殊位置.从而进一步确定其结构为C2H5OH而非CH3-O-CH3
.(3)开发新能源以缓解石油等的短缺引起的能源危机是一个重要课题.据报道,某地近年建设了一个年生产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量.已知生产酒精的方法有如下三种(用化学方程式表示):
方法一:CH2=CH2+H2O
| ||
| △ |
方法二:CH3-CH2Br+H2O
| ||
| △ |
方法三:(C6H10O5)n(淀粉)+n H2O
| 淀粉酶 |
C6H12O6(葡萄糖)
| 酒化酶 |
综合地看,你认为这三种方法中,较好的是
A
A
(填字母),理由是反应原理符合绿色化学的原则,反应物的原子全部转化为期望的最终产物
反应原理符合绿色化学的原则,反应物的原子全部转化为期望的最终产物
.A.方法一 B.方法二 C.方法三
你认为该工厂生产工业酒精用的是
方法三
方法三
(填“方法一”、“方法二”或“方法三”)而不是另外的两种方法的原因是乙烯、溴乙烷都是来自于以石油为原料制得的物质,石油是不可再生的,利用它们制成酒精还不如直接利用石油
乙烯、溴乙烷都是来自于以石油为原料制得的物质,石油是不可再生的,利用它们制成酒精还不如直接利用石油
_.