摘要:27.如图所示.A.B.C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B.C中金属棒分别用导线连接). (1)A中反应的离子方程式为 , Fe Cu Fe Fe Zn (2)B中Cu极的电极反应式为 . 一段时间后溶液的pH值 (填“变大 .“变小 .“不变 ), A B C(3)C中被腐蚀的金属是 .装置中总反应方程式为 .比较A.B.C中铁反应的速率由快到慢的顺序为 .
网址:http://m.1010jiajiao.com/timu3_id_217376[举报]
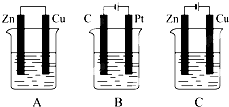
 如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).
如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).(1)A中反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;(2)B中Cu极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
,一段时间后溶液的pH值变大
变大
(填“变大”、“变小”、“不变”);(3)C中被腐蚀的金属是
Zn
Zn
,装置中总反应方程式为Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑
,比较A、B、C中铁反应的速率由快到慢的顺序为B>A>C
B>A>C
(用字母ABC表示).
如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).
(1)A中反应的离子方程式为______;
(2)B中Cu极的电极反应式为______,一段时间后溶液的pH值______(填“变大”、“变小”、“不变”);
(3)C中被腐蚀的金属是______,装置中总反应方程式为______,比较A、B、C中铁反应的速率由快到慢的顺序为______(用字母ABC表示).
 查看习题详情和答案>>
查看习题详情和答案>>
(1)A中反应的离子方程式为______;
(2)B中Cu极的电极反应式为______,一段时间后溶液的pH值______(填“变大”、“变小”、“不变”);
(3)C中被腐蚀的金属是______,装置中总反应方程式为______,比较A、B、C中铁反应的速率由快到慢的顺序为______(用字母ABC表示).
 查看习题详情和答案>>
查看习题详情和答案>>
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.

(1)A、B、C三个装置中属于电解池的是
(2)A池中Cu是
(3)B池中C电极上发生
(4)C池中Cu是
查看习题详情和答案>>

(1)A、B、C三个装置中属于电解池的是
BC
BC
.(2)A池中Cu是
正
正
极,A池中总反应的离子方程式为Zn+Cu2+=Zn2++Cu
Zn+Cu2+=Zn2++Cu
.(3)B池中C电极上发生
还原
还原
反应(填“氧化”或“还原”),B池中总反应的化学方程式为CuCl2
Cl2↑+Cu
| ||
CuCl2
Cl2↑+Cu
.
| ||
(4)C池中Cu是
阳
阳
极,电极反应为Cu-2e-=Cu2+
Cu-2e-=Cu2+
.反应过程溶液中C(Cu2+)不变
不变
(填“变大”“变小”或“不变”).