题目内容
 如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).
如图所示,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸(B、C中金属棒分别用导线连接).(1)A中反应的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;(2)B中Cu极的电极反应式为
2H++2e-=H2↑
2H++2e-=H2↑
,一段时间后溶液的pH值变大
变大
(填“变大”、“变小”、“不变”);(3)C中被腐蚀的金属是
Zn
Zn
,装置中总反应方程式为Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑
,比较A、B、C中铁反应的速率由快到慢的顺序为B>A>C
B>A>C
(用字母ABC表示).分析:(1)铁是较活泼金属,能和稀硫酸发生置换反应;
(2)该电池中铁作负极,铜作正极,溶液中氢离子得电子,根据溶液中氢离子浓度的变化判断溶液的pH值的变化;
(3)该原电池正负极发生的反应式相加即得电池反应式,金属腐蚀快慢与作原电池的正负极的关系判断.
(2)该电池中铁作负极,铜作正极,溶液中氢离子得电子,根据溶液中氢离子浓度的变化判断溶液的pH值的变化;
(3)该原电池正负极发生的反应式相加即得电池反应式,金属腐蚀快慢与作原电池的正负极的关系判断.
解答:解:(1)铁是较活泼金属,能和稀硫酸发生置换反应生成硫酸亚铁和氢气Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(2)原电池中铜作正极,正极上溶液中的氢离子得电子生成氢气2H++2e-=H2↑,因为溶液析出氢气导致溶液中氢离子的浓度降低,溶液的pH值变大.
故答案为:2H++2e-=H2↑;变大;
(3)该原电池中较活泼的金属锌作负极,负极上锌失电子生成锌离子,所以锌被腐蚀;正极上氢离子得电子生成氢气,正负极发生的反应式相加即得电池反应式,所以电池反应式是Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑,
B中铁作负极加速腐蚀,C中铁作正极被保护,所以腐蚀速率快顺序为B>A>C,
故答案为:Zn;Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑;B>A>C.
故答案为:Fe+2H+=Fe2++H2↑;
(2)原电池中铜作正极,正极上溶液中的氢离子得电子生成氢气2H++2e-=H2↑,因为溶液析出氢气导致溶液中氢离子的浓度降低,溶液的pH值变大.
故答案为:2H++2e-=H2↑;变大;
(3)该原电池中较活泼的金属锌作负极,负极上锌失电子生成锌离子,所以锌被腐蚀;正极上氢离子得电子生成氢气,正负极发生的反应式相加即得电池反应式,所以电池反应式是Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑,
B中铁作负极加速腐蚀,C中铁作正极被保护,所以腐蚀速率快顺序为B>A>C,
故答案为:Zn;Zn+H2SO4=ZnSO4+H2或者Zn+2H+=Zn2++H2↑;B>A>C.
点评:本题考查了金属的腐蚀与防护,难度不大,根据教材基础知识解答即可.

练习册系列答案
相关题目


 如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )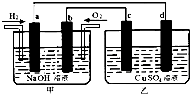 如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( ) 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则: