摘要:29.A.B.C.D 4种元素.其中A.B.C为短周期元素.A元素所处的周期数.主族序数.原子序数均相等,B的原子半径是其所在主族中最小的.B的最高价氧化物对应水化物的化学式为HBO3,C元素原子的最外层电子数比次外层少2个,C的阴离子与D的阳离子具有相同的电子排布.两元素可形成化合物D2C. (1)B元素的名称 ,B在周期表中的位置第 周期.第 族, (2)A.B形成的化合物的电子式 , (3)C的元素符号 .C的最高价氧化物的化学式 , (4) D的最高价氧化物对应的水化物的化学式 .
网址:http://m.1010jiajiao.com/timu3_id_215222[举报]
(10分) A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题: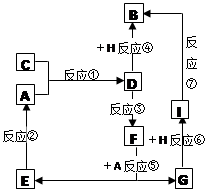
(1) 以上反应中属于化合反应的是___________________ (填序号)
(2) G生成B的过程中所出现的现象
(3)反应⑦的化学方程式为_________________________________
(4)反应③的离子方程式
(5)D的水溶液显_____性,请用离子方程式解释原因 ____________________
(10分) A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素。已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物。请回答下列问题:
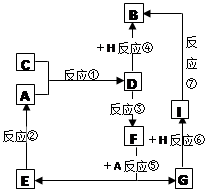
(1) 以上反应中属于化合反应的是___________________ (填序号)
(2) G生成B的过程中所出现的现象
(3)反应⑦的化学方程式为_________________________________
(4)反应③的离子方程式
(5)D的水溶液显_____性,请用离子方程式解释原因 ____________________

(1) 以上反应中属于化合反应的是___________________ (填序号)
(2) G生成B的过程中所出现的现象
(3)反应⑦的化学方程式为_________________________________
(4)反应③的离子方程式
(5)D的水溶液显_____性,请用离子方程式解释原因 ____________________
(10分)A、B、C、D、E、F、G七种元素的原子序数依次递增。已知:
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
①G的原子序数为29,其余的均为短周期主族元素;
②A是宇宙中含量最多的元素,B原子最外层电子数是次外层电子数的2倍,C原子核外有三个未成对电子;
③D和E原子价电子排布式均为ns2np4;④F的单质是黄绿色气体。
请回答下列问题:
(1)G2+的核外电子排布式是 。在[G(NH3)4]2+离子中,G2+与NH3分子形成的是 键。
(2)与B、C形成的阴离子(BC—)互为等电子体的微粒有 、 (分子和离子各写一种)。
(3)B与C形成的化合物中,下列判断正确的是 。
a.氢化物稳定性:B>C b.氢化物沸点:B<C
c.最高价氧化物的水化物酸性:B<C d.非金属性:B>C
(4)B、C、D第一电离能由小到大的顺序为 (用元素符号作答),B的一种氢化物相对分子质量为26,分子中的σ键与π键数目比为 。
(5)七种元素中,电负性最大的元素与B元素形成化合物电子式为 ,该物质的晶体属于 。
a、b、c、d、e、f、g为七种由1~18号元素构成的微粒,它们都有10个电子,其结构特点如下表:
其中b的离子半径大于d的离子半径;c是四原子分子;e与g加热可形成c和f两种分子.试写出:
(1)c分子的结构式为
 ;
;
(2)a和e两种粒子组成化合物的电子式为
 ;
;
(3)a的单质与f反应的化学方程式
(4)d单质与a和e两种粒子组成化合物溶液反应的离子方程式
查看习题详情和答案>>
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 多核 | 单核 | 双核 | 多核 | 多核 |
| 所带单位电荷 | 1+ | 2- | 0 | 3+ | 1- | 0 | 1+ |
(1)c分子的结构式为


(2)a和e两种粒子组成化合物的电子式为


(3)a的单质与f反应的化学方程式
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
;(4)d单质与a和e两种粒子组成化合物溶液反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M.1molM中含有42mol电子.回答下列问题:
(1)E元素在周期表中的位置:

(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):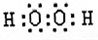
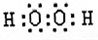 ;
;
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为
查看习题详情和答案>>
(1)E元素在周期表中的位置:
第三周期
第三周期
周期第ⅣA族
第ⅣA族
族;化合物M中含有的化学键类型有离子键和极性共价键
离子键和极性共价键
;用电子式表示化合物A2C的形成过程:

(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):
H2O
H2O
>NH3
NH3
>SiH4
SiH4
;写出C与A形成的18e-化合物的电子式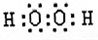
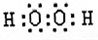
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
;(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为
H2+2OH--2e-=2H2O
H2+2OH--2e-=2H2O
.