摘要:18.下列四种X溶液.与同浓度同体积的盐酸反应.其中反应最快的是 ( )K^S*5U. A.10℃ 20mL 3mol·L-1的X溶液 B.20℃ 20mL 2mol·L-1的X溶液 C.20℃ 10mL 4mol·L-1的X溶液 D.10℃ 10mL 2mol·L-1的X溶液
网址:http://m.1010jiajiao.com/timu3_id_213411[举报]
在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例.某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究.
实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是 (选填序号:A.NaOH B.盐酸C.酒精).
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是: .
乙同学认为是O2,其可能的理由是: .
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是 .
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为: .
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为: mol/L;铁钉中单质铁的质量分数为 .
查看习题详情和答案>>
实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是:
乙同学认为是O2,其可能的理由是:
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为:
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 再投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
日本核泄漏中最危险的是131I,它能引发甲状腺癌.但127I却是人体必需的.
(1)下列有关碘的描述中,正确的是 .
A.
I、
I、
I、
I是四种相同的核素
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射
(2)向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
①b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 .
②已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式 .
(3)①已知反应:2 BrO
+I2=2IO
+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由: .
②n(KBrO3)=4时,对应含碘物质的化学式为 .
(4)含x mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 .
查看习题详情和答案>>
(1)下列有关碘的描述中,正确的是
A.
126 53 |
127 53 |
128 53 |
131 53 |
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射

(2)向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
①b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为
②已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式
(3)①已知反应:2 BrO
- 3 |
- 3 |
②n(KBrO3)=4时,对应含碘物质的化学式为
(4)含x mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为
a、b、c、d
为原子序数依次增大的短周期元素,b、c、d同周期,由a、b、c、d四种元素形成的常见酸式盐A有如图所示的转化关系(图中每种字母表示一种单质或化合物).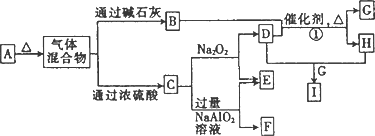
(1)C的原子结构示意图为________.
(2)写出下列物质的化学式:F________,I________.
(3)写出反应①的化学方程式:________.
(4)
将A和E组成的固体混合物X g溶于水配成溶液,向其中慢慢滴入I的稀溶液,测得加入I溶液的体积与生成C的体积(标准状况)如下表所示: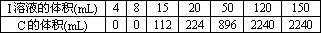
①I溶液的物质的量浓度为________.
②x
的值为________.a、b、c、d
为原子序数依次增大的短周期元素,b、c、d同周期,由a、b、c、d四种元素形成的常见酸式盐A有如图所示的转化关系(图中每种字母表示一种单质或化合物).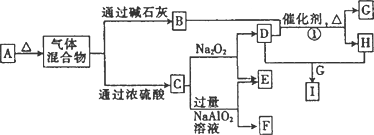
(1)C的原子结构示意图为________.
(2)写出下列物质的化学式:F________,I________.
(3)写出反应①的化学方程式:________.
(4)
将A和E组成的固体混合物X g 溶于水配成溶液,向其中慢慢滴入I的稀溶液,测得加入I溶液的体积与生成C的体积(标准状况)如下表所示: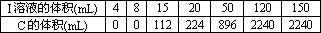
①I溶液的物质的量浓度为________.
②x
的值为________.有X、Y、Z、W四种在中学学过的固体化合物,实验现象如下:
①X、Y、Z、W的焰色反应均为黄色.
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出.
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解.
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现.其中W溶液中气泡出现较快.
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成.
根据上述现象,回答下列问题:
(1)X的化学式为
(2)写出下列有关反应的化学方程式或离子方程式.
①Z+石灰水(离子方程式)
②X+CO2(化学方程式)
③W
(化学方程式)
查看习题详情和答案>>
①X、Y、Z、W的焰色反应均为黄色.
②在Z、W中加入稀盐酸,均有无色、无气味的气体放出.
③Y、Z、W分别与适量的Ba(OH)2浓溶液反应,均有白色沉淀生成;再加入过量盐酸,由Z、W生成的白色沉淀均溶解,由Y生成的白色沉淀不溶解.
④在相同条件下,将足量的Y的溶液分别加到相同物质的量浓度、相同体积的Z和W的溶液中,都有气泡出现.其中W溶液中气泡出现较快.
⑤X与CO2反应生成Z,同时生成另一种气体,此气体由地壳中含量最多的元素组成.
根据上述现象,回答下列问题:
(1)X的化学式为
Na2O2
Na2O2
,Y的化学式为NaHSO4
NaHSO4
;(2)写出下列有关反应的化学方程式或离子方程式.
①Z+石灰水(离子方程式)
Ca2++CO32-═CaCO3↓
Ca2++CO32-═CaCO3↓
;②X+CO2(化学方程式)
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;③W
| △ |
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
.
| ||