摘要:19.A.B.C.D.E五种元素原子序数依次增大.且均不超过18.其中A与C.B与E分别为同族元素.原子半径A<B<E<D<C.B原子最外层电子数是内层电子数的3倍.C.D的核外电子数之和与B.E核外电子数之和相等.下列说法正确的是 A.原子最外层电子数:B<A B.B与E可以形成EB2型化合物 C.A与E形成的化合物是离子化合物 D.最高价氧化物对应的水化物碱性:C<D
网址:http://m.1010jiajiao.com/timu3_id_213191[举报]
A、B、C、D、E五种元素原子序数依次增大,且均不超过18.其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等.下列说法正确的( )
查看习题详情和答案>>
A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族.A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为: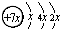 ,E的价层电子排布式为3d64s2.回答下列问题:
,E的价层电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A
(2)用元素符号表示A、C、D电负性由小到大的顺序
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(4)D的氢化物比A的氢化物的沸点
(5)E元素在周期表的位置是
(6)B、C、D最高价氧化物的晶体类型是分别是
查看习题详情和答案>>
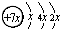 ,E的价层电子排布式为3d64s2.回答下列问题:
,E的价层电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
N
N
BNa
Na
CSi
Si
DP
P
(2)用元素符号表示A、C、D电负性由小到大的顺序
Si<P<N
Si<P<N
.(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
.(4)D的氢化物比A的氢化物的沸点
低
低
(填“高“或“低“),A的氢化物分子立体构型为三角锥形
三角锥形
.(5)E元素在周期表的位置是
第四周期、Ⅷ族
第四周期、Ⅷ族
.(6)B、C、D最高价氧化物的晶体类型是分别是
离子晶体
离子晶体
、原子晶体
原子晶体
、分子晶体
分子晶体
.A、B、C、D、E五种元素原子序数依次增大,已知A、B、C、D均是短周期主族元素.A、B、C同周期且相邻.D、E同主族相邻,D原子最外层电子数与最内层电子数相等.D与B形成的化合物遇水生成两种碱.下列说法正确的是( )
| A、原子半径:E>D>B>C>A | B、化合物BC与化合物DC中化学键类型相同 | C、A的含氢化合物的沸点一定低于C的含氢化合物的沸点 | D、EA2、EC2这两种化合物中,阳离子与阴离子个数比均为1:1 |