摘要:30.溶质质量分数为63%的浓硝酸.密度为1.40g/cm3.试计算: (1)该浓硝酸的物质的量浓度是多大? (2)欲用浓硝酸配制500mL 2.0mol/L的稀硝酸.需取用上述浓硝酸多少mL? (3)取配制好的溶液40mL.与足量铜充分反应.最多可生成气体多少? 注意:310-33题为13.14班同学题目.1-12班同学不做
网址:http://m.1010jiajiao.com/timu3_id_211418[举报]
硝酸具有强的氧化性,并且浓度不同,氧化能力也不同.
(1)质量分数为63%,密度为1.5 g·cm-3的浓硝酸,其物质的量浓度为________.
(2)某学习小组为比较浓、稀硝酸分别与铜反应的不同,需配制100 mL 3 mol·L-1稀硝酸,他们需要量取上述浓硝酸________mL;如下图所示仪器,在配制过程中不需用到的是________(填序号).

除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是________;
硝酸具有强的氧化性,并且浓度不同,氧化能力也不同.
(1)质量分数为63%,密度为1.5 g·cm-3的浓硝酸,其物质的量浓度为________.
(2)某学习小组为比较浓、稀硝酸分别与铜反应的不同,需配制100 mL 3 mol·L-1稀硝酸,他们需要量取上述浓硝酸________mL;如下图所示仪器,在配制过程中不需用到的是________(填序号).
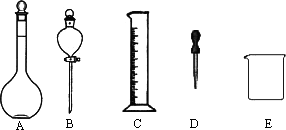
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是________;
4.6g铜镁合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到4480mL NO2和336mL N2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是( )
| A、该合金中铜与镁的物质的量之比是46:69 | B、该浓硝酸中HNO3的物质的量浓度是14.0mol/L | C、产生沉淀8.51g | D、离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |