题目内容
4.6g铜镁合金完全溶解于100ml密度为1.40g/ml、质量分数为63%的浓硝酸中,得到4480mlNO2和336 ml N2O4 的混合气体(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液至离子恰好全部沉淀时,下列说法不正确的是 (??? )
A.该合金中铜与镁的物质的量之比是46:69
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL
D
【解析】
试题分析: A.4480mL NO2的物质的量= =0.2mol,336mL N2O4的物质的量=
=0.2mol,336mL N2O4的物质的量=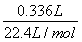 =0.015mol,令Cu、Mg的物质的量分别为xmol、ymol,根据二者质量与电子转移守恒,可得:64x+24y=4.6,2x+2y=0.2+0.015×2 ,解得x=0.046、y=0.069,故该合金中铜与镁的物质的量之比=0.046mol:0.069mol=46:69,故A正确;B.密度为1.40g·mL-1、质量分数为63%的浓硝酸.其物质的量浓度=
=0.015mol,令Cu、Mg的物质的量分别为xmol、ymol,根据二者质量与电子转移守恒,可得:64x+24y=4.6,2x+2y=0.2+0.015×2 ,解得x=0.046、y=0.069,故该合金中铜与镁的物质的量之比=0.046mol:0.069mol=46:69,故A正确;B.密度为1.40g·mL-1、质量分数为63%的浓硝酸.其物质的量浓度=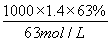 =14mol·L-1,故B正确;C.铜镁合金完全溶解于浓硝酸中,向反应后的溶液中加入NaOH溶液至离子恰好全部沉淀,生成沉淀为Cu(OH)2、Mg(OH)2,由化学式可知n(OH-)=2n(Cu)+2n(Mg)=2×(0.046mol+0.069mol)=0.23mol,故沉淀质量=m(Cu)+m(Mg)+m(OH-)=4.6g+0.23mol×17g·mol-1=8.51g,故C正确;D.离子恰好完全沉淀时,此时溶液中溶质为NaNO3,根据N元素守恒可知n原(HNO3)=n(NaNO3)+n(NO2)+2n(N2O4),故n(NaNO3)=0.1L×14mol·L-1-0.2mol-2×0.015mol=1.17mol,根据钠离子守恒有n(NaOH)=n(NaNO3)=1.17mol,故需要氢氧化钠溶液的体积=
=14mol·L-1,故B正确;C.铜镁合金完全溶解于浓硝酸中,向反应后的溶液中加入NaOH溶液至离子恰好全部沉淀,生成沉淀为Cu(OH)2、Mg(OH)2,由化学式可知n(OH-)=2n(Cu)+2n(Mg)=2×(0.046mol+0.069mol)=0.23mol,故沉淀质量=m(Cu)+m(Mg)+m(OH-)=4.6g+0.23mol×17g·mol-1=8.51g,故C正确;D.离子恰好完全沉淀时,此时溶液中溶质为NaNO3,根据N元素守恒可知n原(HNO3)=n(NaNO3)+n(NO2)+2n(N2O4),故n(NaNO3)=0.1L×14mol·L-1-0.2mol-2×0.015mol=1.17mol,根据钠离子守恒有n(NaOH)=n(NaNO3)=1.17mol,故需要氢氧化钠溶液的体积=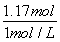 =1.17L=1170mL,故D错误,
=1.17L=1170mL,故D错误,
考点:考查混合物计算。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案| A、该合金中铜与镁的物质的量之比是46:69 | B、该浓硝酸中HNO3的物质的量浓度是14.0mol/L | C、产生沉淀8.51g | D、离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
| A、当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL | B、当金属全部溶解时收集到NO气体的体积一定为2.24L | C、参加反应的金属的总质量为9.6g>m>3.6g | D、当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |