摘要:8.在273℃.101kPa下.将1.40gN2.1.60gO2和4.00gAr混合.该混合气体的体积约为 ( ) A. 3.36L B. 6.72L C. 8.96L D. 4.48L
网址:http://m.1010jiajiao.com/timu3_id_211121[举报]
某气体1L(标态)与适量氧气恰好完全反应生成CO2和水蒸气在273℃ 101kPa下混合气体的体积为b L,当冷却至标准状况下气体体积变为a L,则用a、b表示该烃的分子式为
[ ]
A.CaHb
B.CaHa-b
C.CaHb-2a
D.CaH2(b-a)
能源是人类生存和发展的基础.
(1)我国目前使用的主要能源是化石燃料,化石燃料包括煤、 和天然气.在25℃、101kPa时,1mol H2(g)与适量O2(g)反应生成1mol H2O(l),放出285.8kJ的热量,该反应的热化学方程式可表为 ;用氢气作燃料的主要优点有 (写出一条即可);原电池是将 能转化为电能的装置.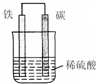
(2)右图是钢铁的吸氧腐蚀示意图,其中碳极(正极)的电极反应式为 .(换图)
(3)为保护地下钢管不受腐蚀,可使它与 (填字母代号).
A.铜板相连 B.碳棒相连
C.直流电源正极相连 D.锌板相连. 查看习题详情和答案>>
(1)我国目前使用的主要能源是化石燃料,化石燃料包括煤、

(2)右图是钢铁的吸氧腐蚀示意图,其中碳极(正极)的电极反应式为
(3)为保护地下钢管不受腐蚀,可使它与
A.铜板相连 B.碳棒相连
C.直流电源正极相连 D.锌板相连. 查看习题详情和答案>>
写出下列反应的热化学方程式(在25℃,101Kpa时).
(1)78g苯完全燃烧生成二氧化碳和液态水,放出3267.5kJ热量
(2)1摩尔C(石墨)与适量水蒸气反应生成一氧化碳和氢气,吸收131.3kJ热量
(3)标准状况下将纯净的C2H41L在空气中完全燃烧,生成CO2气和液态水,放出62.99kJ热量,则CH4燃烧热的热化方程式为:
(4)由氢气和氧气反应生成1摩尔水蒸气放热241.8kJ热量,写出该反应的热化学方程式
查看习题详情和答案>>
(1)78g苯完全燃烧生成二氧化碳和液态水,放出3267.5kJ热量
C6H6(l)+
O2(g)═6CO2(g)+3H2O(l)△H=-3267.5kJ/mol
| 15 |
| 2 |
C6H6(l)+
O2(g)═6CO2(g)+3H2O(l)△H=-3267.5kJ/mol
.| 15 |
| 2 |
(2)1摩尔C(石墨)与适量水蒸气反应生成一氧化碳和氢气,吸收131.3kJ热量
C(s,石墨)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ?mol-1
C(s,石墨)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ?mol-1
.(3)标准状况下将纯净的C2H41L在空气中完全燃烧,生成CO2气和液态水,放出62.99kJ热量,则CH4燃烧热的热化方程式为:
C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1411.0kJ?mol-1
C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1411.0kJ?mol-1
.(4)由氢气和氧气反应生成1摩尔水蒸气放热241.8kJ热量,写出该反应的热化学方程式
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ?mol-1
.在25℃、101kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ?mol-1
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ?mol-1
由此判断下列说法正确的是( )
P4(s)+5O2(g)=P4O10(s);△H=-3093.2kJ?mol-1
4P(s)+5O2(g)=P4O10(s);△H=-2954.0kJ?mol-1
由此判断下列说法正确的是( )
查看习题详情和答案>>
(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ.则表示甲烷燃烧热的热化学方程式为
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ?mol-1):
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=
(3)下列说法正确的是(填序号)
A.相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大.
查看习题详情和答案>>
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol
.(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ?mol-1):
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=
-1928kJ?mol-1
-1928kJ?mol-1
.(3)下列说法正确的是(填序号)
ABD
ABD
:A.相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大;
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气;
D.对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
E.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大.