摘要:17.重铬酸铵[(NH4)2Cr2O7]是一种受热易分解盐.具有很强的氧化性.下列各级对重铬酸铵受热分解产物的判断符合实际的是 A.CrO3+NO2+H2O B. Cr2O3+ NH3+H2O C. CrO3+N2 +H2O D. Cr2O3 +N2 +H2O
网址:http://m.1010jiajiao.com/timu3_id_210991[举报]
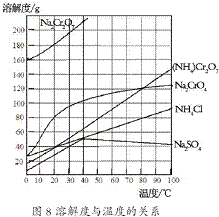 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:步骤1:将铬酸钠溶于适量的水,加入一定量浓硫酸酸化,使铬酸钠转化为重铬酸钠.
步骤2:将上述溶液蒸发结晶,并趁热过滤.
步骤3:将步骤二得到的晶体再溶解,再蒸发结晶并趁热过滤.
步骤4:将步骤三得到的滤液冷却至40℃左右进行结晶,用水洗涤,获得重铬酸钠晶体.
步骤5:将步骤四得到的重铬酸钠和氯化铵按物质的量之比1:2溶于适量的水,加热至105~110℃时,让其充分反应.
(1)步骤1是一个可逆反应,该反应的离子方程式为
2CrO42-+2H+?Cr2O72-+H2O
2CrO42-+2H+?Cr2O72-+H2O
.(2)步骤2、3的主要目的是
除去硫酸钠杂质
除去硫酸钠杂质
.(3)步骤4在40℃左右结晶,其主要目的是
尽量使硫酸钠不析出
尽量使硫酸钠不析出
.(4)步骤5中获得(NH4)2Cr2O7还需补充的操作有
冷却结晶、过滤、洗涤及干燥
冷却结晶、过滤、洗涤及干燥
.(5)(NH4)2Cr2O7受热分解制取Cr2O3的化学方程式为
(NH4)2Cr2O7═Cr2O3+N2↑+4H2O
(NH4)2Cr2O7═Cr2O3+N2↑+4H2O
.(6)对上述产品进行检验和含量测定.
①检验产品中是否有K+,其操作方法及判断依据是
用洁净的铂丝在酒精灯上灼烧至无色,然后蘸取晶体或者其溶液少许,在酒精灯火焰上灼烧,通过蓝色钴玻璃观察,若火焰显示蓝色说明含有钾离子,否则不含
用洁净的铂丝在酒精灯上灼烧至无色,然后蘸取晶体或者其溶液少许,在酒精灯火焰上灼烧,通过蓝色钴玻璃观察,若火焰显示蓝色说明含有钾离子,否则不含
.②为了测定上述产品中(NH4)2Cr2O7的含量,称取样品0.150g,置于锥形瓶中,加50mL水,再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为
84%
84%
(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O2- 3 |
2- 6 |
重铬酸铵[(NH4)2Cr2O7]是一种橘黄色的晶体,常用于石油精炼、制革、印染、烟火、陶瓷等行业,是一种重要的化工产品及原料.
(1)已知在酸性条件下,重铬酸铵有强氧化性.向冷的酸性重铬酸铵溶液中通入H2S可得到Cr3+和S,写出反应的离子方程式: ;
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生如下主要反应:(NH4)2Cr2O7
Cr2O3+4H2O+N2↑,但同时要发生副反应.某同学设计了如下装置,探究副反应的生成物:
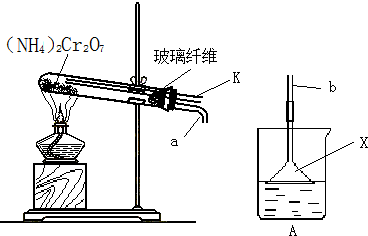
①装置中玻璃纤维的作用是 ;加热前,该同学先通过导管向试管中通一会儿N2,其目的是 ;
②连接a、b,关闭导管K,加热使反应发生.若装置A中所盛溶液为酚酞溶液,其溶液变红,说明有 产生,仪器X的作用是 ;若装置A中所盛溶液为新制的硫酸亚铁溶液,且出现棕红色的沉淀,说明副反应中有 产生,写出产生该沉淀的离子方程式 .
查看习题详情和答案>>
(1)已知在酸性条件下,重铬酸铵有强氧化性.向冷的酸性重铬酸铵溶液中通入H2S可得到Cr3+和S,写出反应的离子方程式:
(2)在150℃时,重铬酸铵迅速呈膨胀式分解,发生如下主要反应:(NH4)2Cr2O7
| ||

①装置中玻璃纤维的作用是
②连接a、b,关闭导管K,加热使反应发生.若装置A中所盛溶液为酚酞溶液,其溶液变红,说明有
重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组关于其分解产物的判断符合实际的是( )
| A、NH3+CrO3+H2O | B、NH3+Cr2O3+H2O | C、N2+CrO3+H2O | D、N2+Cr2O3+H2O |