摘要:1.下列化学符号与名称相符合的是 A.氧元素O2 B.氯离子C1- C.碳酸钠NaCO3 D.金AU
网址:http://m.1010jiajiao.com/timu3_id_210975[举报]

(1)在上面元素周期表中全部是金属元素的区域为
b
b
(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是
Mg
Mg
(填名称),可以验证该结论的实验是
bc
bc
.(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
Al2O3 +2OH-═2AlO2-+H2O
Al2O3 +2OH-═2AlO2-+H2O
、Al(OH)3 +OH-═AlO2-+2H2O
Al(OH)3 +OH-═AlO2-+2H2O
.(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序
C>Si>P
C>Si>P
(填元素符号).②以上元素形成的金属单质中,熔点最低的是
Na
Na
(填元素符号).③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
HCl、H2S、PH3、SiH4
HCl、H2S、PH3、SiH4
(填化学式);④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
Al3+、Mg2+、Na+、O2-、N3-
Al3+、Mg2+、Na+、O2-、N3-
.⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
SiO2+2C
2CO+Si
| ||
SiO2+2C
2CO+Si
.
| ||
⑥c元素的单质用途
氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境
氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境
(填一条).有四种短周期元素的部分性质如下,请根据有关信息填空:
注:气体密度已换算为标准状况
(1)元素W在周期表中的位置
(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为
 ,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
,已知生成1mol该产物将伴随393.51kJ的热量变化,写出该反应的热化学方程式
查看习题详情和答案>>
| 元素 | W | X | Y | Z |
| 原子半径 | 186pm | 99pm | 66pm | 77pm |
| 核外电子 | 有4种能级不同的电子 | 最外层有7种运动状态不同的电子 | 核外电子占有5个轨道 | 有2个未成对电子 |
| 单质 部分 性质 |
密度:0.97g?cm-3 熔点:97.8℃ 能导电 |
沸点:-34.0℃ 不能导电 |
密度:1.43g?L-1 沸点:-183.0℃ 不能导电 |
熔点:3550℃ 能导电 |
(1)元素W在周期表中的位置
第三周期第ⅠA族
第三周期第ⅠA族
,根据性质描述,元素Z的单质是石墨
石墨
(写名称),上述元素的简单离子中半径最小的是Na+
Na+
(写离子符号).(2)短周期主族元素中,元素X以及与其相邻元素的气态氢化物的稳定性由强到弱顺序是:
HF>HCl>H2S
HF>HCl>H2S
(用化学式表示).(3)同族元素单质及其化合物在许多性质上都存在着递变规律.下列有关说法正确的是
b
b
(选填序号).a.元素W所在族,随着原子序数递增,单质的熔点逐渐降低
b.元素X所在族,随着原子序数递增,对应简单离子的还原性逐渐增强
c.元素Y所在族,随着原子序数递增,对应氢化物的沸点逐渐升高
d.元素Z所在族,随着原子序数递增,最高氧化物对应水化物的酸性逐渐增强
(4)Z单质与足量Y单质反应,生成物的电子式为


C(s)+O2(g)=CO2△H=-393.51kJ/mol
C(s)+O2(g)=CO2△H=-393.51kJ/mol
.(2010?信阳二模)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA,ⅢA族的连接处.请用相应的化学用语回答下列问题:
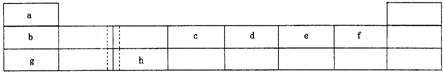
(1)写出由e形成的两种带有相同电荷数阴离子的符号
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式
(3)图1是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“l”代表Ar,则其中柱形“8“代表

(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图2),序列“5”的氢化物的名称是
查看习题详情和答案>>

(1)写出由e形成的两种带有相同电荷数阴离子的符号
O2-
O2-
、O22-
O22-
.(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(3)图1是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“l”代表Ar,则其中柱形“8“代表
Si
Si
.(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(图2),序列“5”的氢化物的名称是
甲烷
甲烷
.(2012?梧州模拟)有关中学常见元素X、Y、Z、D、E的信息如下:
请用相关化学用语回答下列问题:
(1)X在元素周期表中的位置是: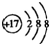
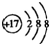 ,D的最高价氧化物化学式为:
,D的最高价氧化物化学式为:
(2)Y、Z的最高价氧化物对应的水化物酸性较强的是(填水化物名称)
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为
(4)E单质在潮湿空气中被腐蚀的正极反应方程式为
查看习题详情和答案>>
| 元素 | 有关信息 |
| X | 元素主要化合价为-2 |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 与X同主族,其单质在X的单质中燃烧,发出蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿的空气中易被腐蚀或损坏 |
(1)X在元素周期表中的位置是:
第二周期ⅥA族
第二周期ⅥA族
,Y的离子结构示意图为: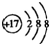
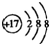
Al2O3
Al2O3
;(2)Y、Z的最高价氧化物对应的水化物酸性较强的是(填水化物名称)
高氯酸
高氯酸
,X、Y、D形成的简单离子的半径由大到小为(填离子符号)Cl->O2->Al3+
Cl->O2->Al3+
;(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;
| ||
(4)E单质在潮湿空气中被腐蚀的正极反应方程式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.