摘要:在50mL 4mol/L的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92g,通过计算确定白色固体的组成及各组分的质量.
网址:http://m.1010jiajiao.com/timu3_id_208907[举报]
(2011?朝阳区二模)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)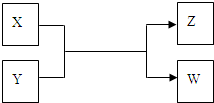
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是
Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是
(2)若用下列装置只进行Z+W═X+Y反应(夹持装置未画出):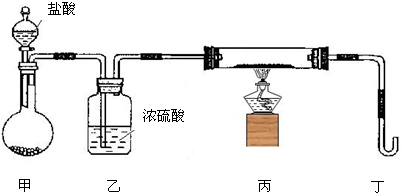
①完成此实验有多步操作,其中三步是:
a.点燃酒精灯
b.滴加盐酸
c.检验气体纯度
这三步操作的先后顺序是
②为保证实验成功,上述装置需要改进,方法是(用文字叙述)
(3)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液
查看习题详情和答案>>

Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是
黄绿色
黄绿色
.(2)工业上Z有多种用途,用化学方程式表示Z的一种用途
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
| ||
2NaCl+2H2O
H2↑+Cl2↑+2NaOH
.
| ||
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是
3Cl2+I-+3H2O═6Cl-+IO3-+6H+
3Cl2+I-+3H2O═6Cl-+IO3-+6H+
.Ⅱ.若X是工业上用量最大的金属单质,Z是一种具有磁性的黑色晶体,则:
(1)X与Y反应的化学方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
.
| ||
(2)若用下列装置只进行Z+W═X+Y反应(夹持装置未画出):

①完成此实验有多步操作,其中三步是:
a.点燃酒精灯
b.滴加盐酸
c.检验气体纯度
这三步操作的先后顺序是
bca
bca
(填字母).②为保证实验成功,上述装置需要改进,方法是(用文字叙述)
在甲、乙装置中间增加一个装有水的洗气瓶
在甲、乙装置中间增加一个装有水的洗气瓶
.(3)将3.48g Z加入50mL 4mol/L的稀HNO3中充分反应,产生112mL的NO(标准状况),向反应后的溶液中滴加NaOH溶液能产生沉淀.当沉淀量最多,至少需要加入2mol/L的NaOH溶液
97.5
97.5
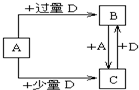
mL (精确到0.1). 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素.
①B属于分子
非极性
非极性
(填“极性”或“非极性”),B分子中各原子最外层是
是
(填“是”或“否”)都满足8电子结构;②向50mL 4mol/L的NaOH溶液中通入1.12L B(标准状况),反应后溶液中溶质的物质的量之比为
n(Na2CO3):n(NaOH)═1:2
n(Na2CO3):n(NaOH)═1:2
(填化学式和物质的量之比);③4g A单质完全燃烧放出131.2kJ的热量,写出表示A单质燃烧热的热化学方程式
C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol
.(2)若A为第三周期中的元素所形成的氯化物.
①写出A溶液→B的离子方程式
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
;②写出A和B的溶液反应的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象.已知:X为含有非极键的离子化合物,且1mol X含有38mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式
4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+
. W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:(1)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,写出其中两种离子发生反应生成两种分子的离子方程式
NH4++OH-=NH3↑+H2O
NH4++OH-=NH3↑+H2O
.(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出该反应的化学方程式
CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
| 浓H2SO4 |
| △ |
CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
.| 浓H2SO4 |
| △ |
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(4)已知由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如图所示的转化关系.
①写出A与B反应生成C的化学方程式
CO2+C
2CO
| ||
CO2+C
2CO
;
| ||
②向50mL 4mol?L-1的NaOH溶液中通入1.12L B(标准状况),反应后溶液中溶质的物质的量之比为
n(Na2CO3):n(NaOH)=1:2
n(Na2CO3):n(NaOH)=1:2
.(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离子浓度由大到小的顺序为
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
. W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:(1)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出C的结构简式为:
CH3COOCH2CH3
CH3COOCH2CH3
.(2)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式:
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
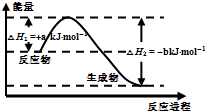
(3)XW4是一种重要能源物质,如图是1.01×105Pa下,1mol XW4燃烧生成稳定化合物过程中的能量变化示意图,其热化学方程式为:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-(b-a)kJ?mol-1
;(4)向50mL 4mol?L-1的NaOH溶液中通入4.48L元素X的最高价氧化物(标准状况),反应后溶液呈
碱性
碱性
,填(“中性”、“酸性”、或“碱性”),理由是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离子浓度由大到小的顺序为:
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。常温下A为液态,D为固态,B、C、E、G为气态(C可以使带火星木条复燃),其中B、C、D为单质,F为淡黄色粉末状化合物,I的焰色反应为黄色。

请回答:(1)写出F的电子式 。(2)G的结构式是 。
(3)反应④是 反应(填“吸热”或者“放热”)
(4)写出反应⑤的化学反应方程式
(5)B、C单质已被应用于字宙飞船的燃料电池中,如图所示。若将B换成甲烷也能组成燃料电池(两个电极均由多孔性碳构成),该电池工作时:

①b电极附近溶液的pH将 (填“增大”“减小”“不变”);
②a电极上的电极反应式为: 。
(6)在标准状况下,若将3.36L气体G通入50mL 4mol/L的H溶液中,用一个离子方程式表示其过程:
查看习题详情和答案>>