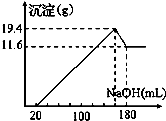
摘要:22.取50mL稀硫酸与一定质量的镁.铝合金反应.合金全部溶解.向所得溶液中滴加5mol·L-1 NaOH溶液到过量.生成沉淀质量与加入NaOH溶液体积关系如图.则 A.原合金中铝质量为7.8g B.原合金的质量为19.4g C.原合金中镁的质量为4.8g D.硫酸的物质的量浓度为5mol·L-1 第Ⅱ卷
网址:http://m.1010jiajiao.com/timu3_id_208658[举报]
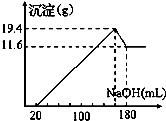
取50mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液到过量,生成沉淀质量与加入NaOH溶液体积关系如图,则( )
查看习题详情和答案>>

| A.原合金中铝质量为7.8g |
| B.原合金的质量为19.4g |
| C.原合金中镁的质量为4.8g |
| D.硫酸的物质的量浓度为5mol?L-1 |
取50mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液到过量,生成沉淀质量与加入NaOH溶液体积关系如图,则( )
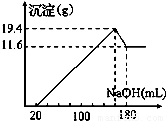
A.原合金中铝质量为7.8g
B.原合金的质量为19.4g
C.原合金中镁的质量为4.8g
D.硫酸的物质的量浓度为5mol?L-1
查看习题详情和答案>>

A.原合金中铝质量为7.8g
B.原合金的质量为19.4g
C.原合金中镁的质量为4.8g
D.硫酸的物质的量浓度为5mol?L-1
查看习题详情和答案>>
取50mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液到过量,生成沉淀质量与加入NaOH溶液体积关系如图,则
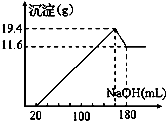
- A.原合金中铝质量为7.8g
- B.原合金的质量为19.4g
- C.原合金中镁的质量为4.8g
- D.硫酸的物质的量浓度为5mol?L-1
某课外兴趣小组为了探究某种铝合金(合金元素为Mg)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计了下图装置进行实验。
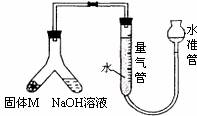
(1)如何检验该装置是否密封____________________;
(2)固体M与氢氧化钠溶液反应的离子方程式_______;
(3)倾斜A使氢氧化钠溶液(足量)与合金粉末(固体M)ag充分反应,待反应停止后,反应后进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M的质量应_________;
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积____(填“>”、“<”、“=”) VmL。若a =38mg,V=44.8mL,该合金________(填“符合”、“不符合”)国家标准;
(5)另一兴趣小组利用该装置测定Mg的相对原子质量。需要直接测定的物理量为______;
a.加入稀硫酸(浓度已知)的体积 b.镁条的质量 c.量气管读数
若测定结果偏小,可能的原因是_____________。
a.镁条表面氧化膜未除尽 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却即读取量气管读数 d.装置漏气
查看习题详情和答案>>