题目内容
取50mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液到过量,生成沉淀质量与加入NaOH溶液体积关系如图,则( )
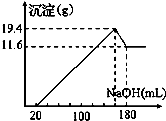

分析:镁、铝与稀硫酸反应生成硫酸镁、硫酸铝,合金全部溶解,向所得溶液中滴加5mol?L-1 NaOH溶液20ml,与过量的硫酸反应生成硫酸钠,此时溶液为硫酸镁、硫酸钠、硫酸铝的混合物,继续加入氢氧化钠到增大沉淀量,金属镁离子铝离子沉淀完全,氢氧化镁与氢氧化铝质量为19.4g,再继续加入氢氧化钠至氢氧化铝全部溶解,再加入氢氧化钠沉淀量不变,则氢氧化镁沉淀的质量为11.6g.
解答:解:A、氢氧化铝的质量为19.4-11.6=7.8g,故A错误;
B、氢氧化铝和氢氧化铝沉淀的总质量为19.4g,故原合金质量一定小于19.4g,故B错误;
C、氢氧化镁的物质的量等于金属镁的物质的量=
×24g/mol=4.8g,故C正确;
D、氢氧化钠溶液加入到溶液至沉淀量最大量时,硫酸全部生成硫酸钠,硫酸物质的量等于氢氧化钠物质的量的
,根据图象可知氢氧化镁物质的量等于镁的物质的量=
=0.2mol;氢氧化铝物质的量=
=0.1mol,生成这些沉淀共需氢氧化钠物质的量=0.2mol×2+0.1mol×3=0,7mol,需要氢氧化钠的体积为
=0.14L,所以加入氢氧化钠的体积共160ml,此时硫酸根全为硫酸钠,则根据关系;2NaOH~Na2SO4~H2SO4可知 硫酸物质的量=
=0.4mol,硫酸的浓度=
=8mol/L,故D错误;
故选C.
B、氢氧化铝和氢氧化铝沉淀的总质量为19.4g,故原合金质量一定小于19.4g,故B错误;
C、氢氧化镁的物质的量等于金属镁的物质的量=
| 11.6g |
| 58g/mol |
D、氢氧化钠溶液加入到溶液至沉淀量最大量时,硫酸全部生成硫酸钠,硫酸物质的量等于氢氧化钠物质的量的
| 1 |
| 2 |
| 4.8g |
| 24g/mol |
| 7.8g |
| 78g/mol |
| 0.7mol |
| 5mol/L |
| 0.16L×5 |
| 2 |
| 0.4mol |
| 0.05L |
故选C.
点评:本题考查混合物的计算,注意判断加入的NaOH溶液反应的过程,分析各过程的产物为解答该题的关键,同时考查了图象的分析应用.

练习册系列答案
相关题目
 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂