摘要:22. 如下图转化关系.A.B.C为气态单质.E常温下为液态.F为黑色固体.G为淡黄色固体.C.F和G中均含有同一元素.反应条件和生成物状态均已略去. 请回答下列问题: (1) 写出下列物质的化学式:A B H (2) 写出下列反应的离子方程式: 反应(i): A+E: 的化学方程式.并用双线桥标明电子转移的方向和数目.
网址:http://m.1010jiajiao.com/timu3_id_208081[举报]
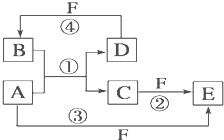 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)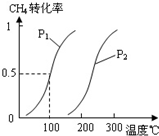 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+2H2O
Cl2+2OH-=Cl-+ClO-+2H2O
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).(3)由A、C、D元素原子组成的化合物N2H4和H2O2有广泛的用途.
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.电池放电时,负极的电极反应式为
N2H4+4OH-=N2↑+4H2O+4e-
N2H4+4OH-=N2↑+4H2O+4e-
.②已知:16g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75KJ的热量.
H2O(1)=H2O(g)△H=+44kJ?mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1
写出N2H4(肼)与氧气反应的热化学方程式为
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
.或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为


C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
,已知光照条件下D与F反应生成B,写出该反应的化学方程式:H2+Cl2
2HCl
| ||
H2+Cl2
2HCl
.
| ||
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为
2C+SiO2
Si+2CO↑
| ||
2C+SiO2
Si+2CO↑
.
| ||
 A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.
A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是:
2C+SiO2
2CO+Si
| ||
2C+SiO2
2CO+Si
.
| ||
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是:
2Fe+Cl2=2Fe3+
2Fe+Cl2=2Fe3+
;A元素在于周期表中的位置是第四周期,第ⅤⅢ族
第四周期,第ⅤⅢ族
.(3)若B、C、F都是气态单质,且B有毒;③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则该白烟物质的电子式是


4NH3+O2
4NO+6H2O
| ||
| △ |
4NH3+O2
4NO+6H2O
.
| ||
| △ |
(4)若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是:
C+4HNO3
4NO2↑+CO2↑+2H2O
| ||
C+4HNO3
4NO2↑+CO2↑+2H2O
.
| ||
A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品).

(1)若D为氧气,C为NaAlO2,试写出B转化为C的化学方程式
(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性.试写A转化为B的化学方程式
(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,请写出B转化为C的离子方程式
(4)若A常温下为固态单质,化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,且D、E为同一物质,则B为
(5)若B、D为质子数小于18的元素原子形成的单质,A、E、C均为氧化物,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,请写出A转化为B的化学方程式
查看习题详情和答案>>

(1)若D为氧气,C为NaAlO2,试写出B转化为C的化学方程式
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
.(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性.试写A转化为B的化学方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
.画出组成单质A的元素原子结构示意图.(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,请写出B转化为C的离子方程式
2Br-+Cl2=Br2+2Cl-
2Br-+Cl2=Br2+2Cl-
.(4)若A常温下为固态单质,化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,且D、E为同一物质,则B为
SO2
SO2
.(5)若B、D为质子数小于18的元素原子形成的单质,A、E、C均为氧化物,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,请写出A转化为B的化学方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||