摘要:18.碱金属和卤族是高中化学中典型的金属元素和非金属元素.☆考♂资♀源?网 ☆ (1)碱金属元素和卤族元素在自然界里都以 (填“化合态 或“游离态 )存在.碱金属元素包括 (填元索符号.Fr除外.下同).Na.K.Rb.Cs.它们中金属性最强的是 .其单质的熔点.沸点逐渐 (填“升高 .“降低 或“不变 ). (2)氯气可溶解于水.部分能够与水起反应.回答下列问题: ①写出氯气与水反应的离子方程式为: , ②氯水经光照后.黄绿色消失.并放出无色气体.该反应的化学方程式是: . ③新制的氯水有多重性.在加有淀粉的碘化钾溶液中滴加新制的氯水.溶液变蓝色该反应的化学方程式是: . (3)碘受热直接变成紫色的蒸气.这种现象称为 .
网址:http://m.1010jiajiao.com/timu3_id_208053[举报]
醋酸和盐酸是高中化学中常见的两种酸,下列说法正确的是( )
A.物质的量浓度相同的盐酸和醋酸溶液中的H+浓度也相同
B.相同浓度的醋酸和醋酸钠溶液混合,得到溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=2的两溶液稀释100倍后,pH都为4
D.两溶液中都加入钾盐,H+浓度都减小
查看习题详情和答案>>
A.物质的量浓度相同的盐酸和醋酸溶液中的H+浓度也相同
B.相同浓度的醋酸和醋酸钠溶液混合,得到溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.pH=2的两溶液稀释100倍后,pH都为4
D.两溶液中都加入钾盐,H+浓度都减小
查看习题详情和答案>>
醋酸和盐酸是高中化学中常见的两种酸,下列说法正确的是( )
查看习题详情和答案>>
| A.物质的量浓度相同的盐酸和醋酸溶液中的H+浓度也相同 |
| B.相同浓度的醋酸和醋酸钠溶液混合,得到溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.pH=2的两溶液稀释100倍后,pH都为4 |
| D.两溶液中都加入钾盐,H+浓度都减小 |
Cl2和SO2是中学化学中常见的气体.
(1)某活动小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
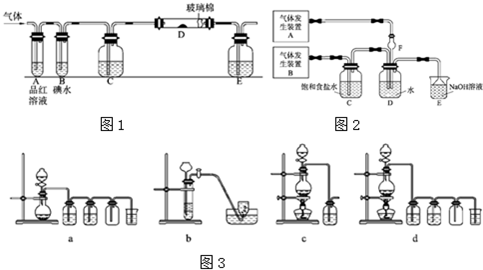
①从左端通入SO2时和通入Cl2时,装置A中观察到的现象是否相同 ?(填“相同”或“不同”之一).
②装置E中盛放的物质可以为 ;若装置D装的是铁粉,通入Cl2与铁粉充分反应时现象为 .
③若装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子.该反应的化学方程式为 .
④若由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解.写出Cl2与含X的溶液反应的离子方程式 (离子方程式不必配平).
(2)为了探究Cl2、SO2同时通入H2O中发生的反应,某兴趣小组同学设计了如下图所示的实验装置.
①气体发生装置A产生的气体是 ;若Cl2和SO2在装置D中恰好完全反应,写出反应的离子方程式 .
②实验室制备SO2和Cl2通常采用下列反应:
Na2SO3+H2SO4(浓) Na2SO4+H2O+SO2↑;
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,下列所给仪器装置中能够制备并收集干燥、纯净Cl2的装置为 (填下列各项序号).
③设计实验验证通入D装置中的气体是Cl2过量还是SO2过量.(简要说明实验步骤、现象和结论) .仪器自选;可供选择试剂:①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液.
查看习题详情和答案>>
(1)某活动小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

①从左端通入SO2时和通入Cl2时,装置A中观察到的现象是否相同
②装置E中盛放的物质可以为
③若装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子.该反应的化学方程式为
④若由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解.写出Cl2与含X的溶液反应的离子方程式
(2)为了探究Cl2、SO2同时通入H2O中发生的反应,某兴趣小组同学设计了如下图所示的实验装置.
①气体发生装置A产生的气体是
②实验室制备SO2和Cl2通常采用下列反应:
Na2SO3+H2SO4(浓) Na2SO4+H2O+SO2↑;
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,下列所给仪器装置中能够制备并收集干燥、纯净Cl2的装置为
③设计实验验证通入D装置中的气体是Cl2过量还是SO2过量.(简要说明实验步骤、现象和结论)
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.(1)实验室可由多种途径制取SO2.
途径Ⅰ:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径Ⅱ:铜与浓硫酸加热制取.
如果要在实验室制取SO2,选用上述两种方法中的
途径I
途径I
(填“途径Ⅰ”或“途径Ⅱ”)更合理,你的理由是制备等量的二氧化硫消耗的硫酸少
制备等量的二氧化硫消耗的硫酸少
(答出一点就可).(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
装置B、C、D的作用分别是:
B
向上排空气收集氯气
向上排空气收集氯气
;
C
安全瓶作用:防止D中的液体倒吸进入集气管B中
安全瓶作用:防止D中的液体倒吸进入集气管B中
;D
吸收尾气,防止氯气扩散到空气中污染环境
吸收尾气,防止氯气扩散到空气中污染环境
.(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质.
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为:
品红溶液红色褪色
品红溶液红色褪色
,说明二氧化硫具有漂白性
漂白性
性.②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为:
溶液紫色先变红,后褪色
溶液紫色先变红,后褪色
,原因是氯气与水反应生成的酸使紫色变为红色,同时生成的HClO具有漂白性,使溶液红色褪去
氯气与水反应生成的酸使紫色变为红色,同时生成的HClO具有漂白性,使溶液红色褪去
.③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为
溶液由紫色变为红色
溶液由紫色变为红色
,与②现象不同的原因是Cl2+SO2+2H2O=2HCl+H2SO4
Cl2+SO2+2H2O=2HCl+H2SO4
(书写相应的化学方程式).