题目内容
Cl2和SO2是中学化学中常见的气体.
(1)某活动小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
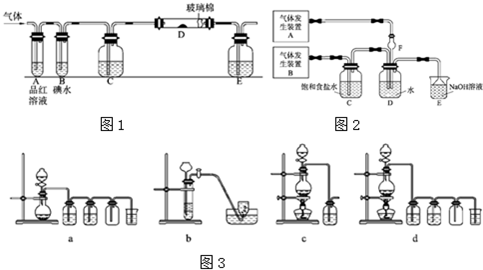
①从左端通入SO2时和通入Cl2时,装置A中观察到的现象是否相同 ?(填“相同”或“不同”之一).
②装置E中盛放的物质可以为 ;若装置D装的是铁粉,通入Cl2与铁粉充分反应时现象为 .
③若装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子.该反应的化学方程式为 .
④若由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解.写出Cl2与含X的溶液反应的离子方程式 (离子方程式不必配平).
(2)为了探究Cl2、SO2同时通入H2O中发生的反应,某兴趣小组同学设计了如下图所示的实验装置.
①气体发生装置A产生的气体是 ;若Cl2和SO2在装置D中恰好完全反应,写出反应的离子方程式 .
②实验室制备SO2和Cl2通常采用下列反应:
Na2SO3+H2SO4(浓) Na2SO4+H2O+SO2↑;
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,下列所给仪器装置中能够制备并收集干燥、纯净Cl2的装置为 (填下列各项序号).
③设计实验验证通入D装置中的气体是Cl2过量还是SO2过量.(简要说明实验步骤、现象和结论) .仪器自选;可供选择试剂:①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液.
(1)某活动小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.

①从左端通入SO2时和通入Cl2时,装置A中观察到的现象是否相同
②装置E中盛放的物质可以为
③若装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子.该反应的化学方程式为
④若由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解.写出Cl2与含X的溶液反应的离子方程式
(2)为了探究Cl2、SO2同时通入H2O中发生的反应,某兴趣小组同学设计了如下图所示的实验装置.
①气体发生装置A产生的气体是
②实验室制备SO2和Cl2通常采用下列反应:
Na2SO3+H2SO4(浓) Na2SO4+H2O+SO2↑;
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
据此,下列所给仪器装置中能够制备并收集干燥、纯净Cl2的装置为
③设计实验验证通入D装置中的气体是Cl2过量还是SO2过量.(简要说明实验步骤、现象和结论)
分析:(1)①二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性;
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用碱液吸收;
氯气与铁反应产生棕红色的烟;
③通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
④由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,则N(S):N(O)=
:
=2:3,则X为S2O32-,含S2O32-的溶液与氯气反应,有淡黄色沉淀生成,该淡黄色沉淀为S,上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解,说明生成SO42-,根据氧化还原反应,氯气被还原为氯离子,据此书写;
(2)①由装置图可知,A装置产生的气体为二氧化硫;
氯气与二氧化硫在溶液中反应生成盐酸与硫酸;
②制备氯气需要加热,生成的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥,利用向上排空气法生成,用氢氧化钠溶液吸收尾气,防止污染空气;
③利用氯水与二氧化硫的漂白性进行设计,取适量D中溶液加热品红溶液中,再加热,根据颜色变化进行判断.
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用碱液吸收;
氯气与铁反应产生棕红色的烟;
③通入足量的氯气,碘完全反应,根据转移电子数目计算I元素在氧化产物中的化合价,确定产物,据此书写;
④由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,则N(S):N(O)=
| 4 |
| 32 |
| 3 |
| 16 |
(2)①由装置图可知,A装置产生的气体为二氧化硫;
氯气与二氧化硫在溶液中反应生成盐酸与硫酸;
②制备氯气需要加热,生成的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥,利用向上排空气法生成,用氢氧化钠溶液吸收尾气,防止污染空气;
③利用氯水与二氧化硫的漂白性进行设计,取适量D中溶液加热品红溶液中,再加热,根据颜色变化进行判断.
解答:解:(1)①二氧化硫具有漂白性,氯气与水反应生成HClO,HClO具有漂白性,故通入二氧化硫与通入氯气,装置A中的品红溶液都褪色,故答案为:相同;
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用NaOH溶液吸收;氯气与铁反应产生棕红色的烟,故答案为:NaOH溶液;产生棕红色的烟;
③装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子,故I元素在氧化产物中的化合价为
=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3,故答案为:5Cl2+I2+6H2O=10HCl+2HIO3;
④由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,则N(S):N(O)=
:
=2:3,则X为S2O32-,含S2O32-的溶液与氯气反应,有淡黄色沉淀生成,该淡黄色沉淀为S,上层清液加入氯化钡溶液,有白色沉淀产生,且沉淀加盐酸不溶解,说明生成SO42-,根据氧化还原反应,氯气被还原为氯离子,反应离子方程式为:H2O+S2O32-+Cl2=S↓+SO42-+2Cl-+2H+,故答案为:H2O+S2O32-+Cl2=S↓+SO42-+2Cl-+2H+;
(2)①由装置图可知,A装置产生的气体为二氧化硫;氯气与二氧化硫在溶液中反应生成盐酸与硫酸,反应离子方程式为:SO2 SO2+Cl2+2H2O=SO2-4+2Cl-+4H+,
故答案为:SO2;SO2 SO2+Cl2+2H2O=SO2-4+2Cl-+4H+;
②制备氯气需要加热,生成的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥,利用向上排空气法生成,用氢氧化钠溶液吸收尾气,防止污染空气,故选择d装置,故答案为:d;
③取适量D中溶液滴加至盛有品红溶液试剂的试管内,红色褪成无色,加热后又变为红色,说明二氧化硫过量,若加热不挥发红色,说明氯气过量,
故答案为:取适量D中溶液滴加至盛有品红溶液试剂的试管内,红色褪成无色,加热后又变为红色,说明二氧化硫过量,若加热不挥发红色,说明氯气过量.
②由装置可知,E的作用是吸收尾气,防止污染空气,可以用NaOH溶液吸收;氯气与铁反应产生棕红色的烟,故答案为:NaOH溶液;产生棕红色的烟;
③装置B中装有10.0mL 1.0mol?L-1的碘水,当通入足量Cl2完全反应后,共转移了0.1mol电子,故I元素在氧化产物中的化合价为
| 0.1mol |
| 0.01L×1mol/L×2 |
④由元素S和O组成-2价酸根离子X,X中S和O的质量比4:3,则N(S):N(O)=
| 4 |
| 32 |
| 3 |
| 16 |
(2)①由装置图可知,A装置产生的气体为二氧化硫;氯气与二氧化硫在溶液中反应生成盐酸与硫酸,反应离子方程式为:SO2 SO2+Cl2+2H2O=SO2-4+2Cl-+4H+,
故答案为:SO2;SO2 SO2+Cl2+2H2O=SO2-4+2Cl-+4H+;
②制备氯气需要加热,生成的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥,利用向上排空气法生成,用氢氧化钠溶液吸收尾气,防止污染空气,故选择d装置,故答案为:d;
③取适量D中溶液滴加至盛有品红溶液试剂的试管内,红色褪成无色,加热后又变为红色,说明二氧化硫过量,若加热不挥发红色,说明氯气过量,
故答案为:取适量D中溶液滴加至盛有品红溶液试剂的试管内,红色褪成无色,加热后又变为红色,说明二氧化硫过量,若加热不挥发红色,说明氯气过量.
点评:本题考查氯气的制备、对装置的理解与分析、氧化还原反应、氯气与二氧化硫的性质、实验方案设计等,难度中等,(1)中④注意根据电子注意判断I元素在氧化产物中的化合价,是对学生综合能力的考查.

练习册系列答案
相关题目
 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题: 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
 已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )