摘要:18.将15mL2 mol·L-1Na2CO3溶液逐滴加入到40mi.0.5 mol·L-1MCl盐溶液中.恰好将溶液中的离子完全沉淀为碳酸盐.则MCl中值是 A.4 B.3 C.2 D.1
网址:http://m.1010jiajiao.com/timu3_id_206388[举报]
 (2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.
(2013?资阳二模)某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O.某学习小组拟探究该消毒液的变质情况.(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过下列装置检验气体的成分可以判断消毒液是否变质.
学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:
全部变质
全部变质
.为了验证可能为甲,请完成下列实验方案.限选试剂:
①98%的浓硫酸 ②1%的品红溶液 ③1.0mol?L-1 的KI-淀粉溶液 ④1.0mol?L-1的NaOH溶液 ⑤澄清石灰水 ⑥饱和NaCl溶液
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 ③ ③ (填序号);试管B中加1%品红溶液; 试管C中加 ⑤ ⑤ (填序号). |
若 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 ,则甲成立. |
①量取25.00mL消毒液放入锥形瓶中,加入过量的a mol?L-1 Na2SO3溶液v1 mL;
②在使用滴定管之前首先进行的操作是
检查滴定管是否漏液(或检漏
检查滴定管是否漏液(或检漏
;将b mol?L-1的酸性KMnO4溶液装入酸式滴定管
酸式滴定管
中;滴定,KMnO4和剩余的Na2SO3发生反应.当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据.③重复滴定操作2次,平均消耗酸性KMnO4溶液v2 mL.则消毒液中NaClO的浓度为
av1-
| ||
| 25 |
av1-
| ||
| 25 |
(1)已知NaHA水溶液呈碱性.
①用离子方程式表示NaHA水溶液呈碱性的原因
②在NaHA水溶液中各离子浓度的大小关系是
(2)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(3)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
.
查看习题详情和答案>>
①用离子方程式表示NaHA水溶液呈碱性的原因
HA-+H2O?H2A+OH-
HA-+H2O?H2A+OH-
②在NaHA水溶液中各离子浓度的大小关系是
c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-)
c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-)
(2)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+
Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+
.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)(3)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于动态平衡.
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-.
①NaHA溶液
②已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.降低温度时,Ksp
(2)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,则液氨的电离方程式为
(3)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
(4)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,则用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数
×10-7
×10-7.
查看习题详情和答案>>
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-.
①NaHA溶液
显酸性
显酸性
(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).②已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.降低温度时,Ksp
减小
减小
(填“增大”、“减小”或“不变”,下同);滴加少量浓盐酸,c(Ca2+)增大
增大
.(2)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,则液氨的电离方程式为
2NH3?NH2-+NH4+
2NH3?NH2-+NH4+
;在液氨中加入NH4Cl,则平衡将向逆向
逆向
移动(填“正向”或“逆向”).(3)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是
1×1010
1×1010
.(4)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,则用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数
| b |
| a-b |
| b |
| a-b |
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
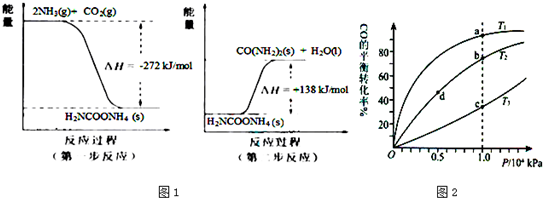
(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
.
查看习题详情和答案>>
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
0.3mol/(L.min)
0.3mol/(L.min)
,N2的转化率=50%
50%
,化学平衡常数K=0.59
0.59
.(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
.(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
BCD
BCD
(填字母)A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
中
中
)性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |

(1)某温度下,纯水的c(H+)=2×10-7mol?L-1,则此时c(OH-)为
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
O2(g)═H2O(g)△H2=-242.0kJ/mol
③CO(g)+
O2(g)═CO2(g)△H3=-283.0kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)常温下,0.1 mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
(5)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显
查看习题详情和答案>>
2×10-7 mol?L-1
2×10-7 mol?L-1
;若温度不变,滴入稀盐酸使c(H+)=5×10-4mol?L-1则溶液中c(OH-)为8×10-11mol?L-1
8×10-11mol?L-1
,由水电离产生的c(H+)为8×10-11mol?L-1
8×10-11mol?L-1
,此时温度高于
高于
(填“高于”、“低于”或“等于”25℃)(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
| 1 |
| 2 |
③CO(g)+
| 1 |
| 2 |
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ/mol
.(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
2NH3?H2O+Cu2+=Cu(OH)2↓+2NH4+
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).(4)常温下,0.1 mol?L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
>
>
c(CO32-)(填“>”、“=”或“<”).(5)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”),a>
>
0.01mol?L-1(填“>”、“=”或“<”).