题目内容
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
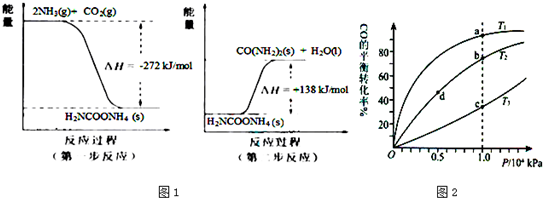
(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
.
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
0.3mol/(L.min)
0.3mol/(L.min)
,N2的转化率=50%
50%
,化学平衡常数K=0.59
0.59
.(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
.(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
BCD
BCD
(填字母)A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
中
中
)性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |

分析:(1)由N2+3H2?2NH3可知,
开始 2 6 0
转化 x 3x 2x
平衡 (2-x)(6-3x) 2x
5min时反应达到平衡,此时容器内的压强变为原来的
,利用物质的量与压强成正比计算x,
以此计算反应速率、转化率、化学平衡常数;
(2)由反应进程和盖斯定律可知,两步进程相加可得NH3(g) 与CO2(g) 反应生成尿素的热化学方程式;
(3)A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,CO的转化率越大,K越大;
C.温度相同,K相同;
D.压强越大,反应速率越大;
E.CO转化率的越大,n总越小,由M=
判断;
(4)a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),由电荷守恒分析酸碱性;NH3?H2O的电离常数Kb=
.
开始 2 6 0
转化 x 3x 2x
平衡 (2-x)(6-3x) 2x
5min时反应达到平衡,此时容器内的压强变为原来的
| 3 |
| 4 |
以此计算反应速率、转化率、化学平衡常数;
(2)由反应进程和盖斯定律可知,两步进程相加可得NH3(g) 与CO2(g) 反应生成尿素的热化学方程式;
(3)A.该反应为放热反应,温度越低,CO的转化率越大;
B.由图可知,CO的转化率越大,K越大;
C.温度相同,K相同;
D.压强越大,反应速率越大;
E.CO转化率的越大,n总越小,由M=
| m |
| n |
(4)a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),由电荷守恒分析酸碱性;NH3?H2O的电离常数Kb=
| c(OH-)c(NH4+) |
| c(NH3.H2O) |
解答:解:(1)由N2+3H2?2NH3可知,
开始 2 6 0
转化 x 3x 2x
平衡 (2-x)(6-3x) 2x
5min时反应达到平衡,此时容器内的压强变为原来的
,
由物质的量与压强成正比可知
=
,解得x=1,
则0-5min该反应的化学反应速率为V(H2)=
=0.3mol/(L.min),
N2的转化率为
×100%=50%,
由平衡时的浓度可知化学平衡常数K=
=0.59,
故答案为:0.3mol/(L.min);50%;0.59;
(2)由反应进程和盖斯定律可知,两步进程相加可得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-272kJ/mol+(+138kJ/mol)=-134kJ/mol,
即反应生成尿素的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol;
(3)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;
B.由图可知,CO的转化率越大,K越大,则K(a)>K(c),故B正确;
C.温度相同,K相同,则K(b)=K(d),故C正确;
D.压强越大,反应速率越大,b点压强大,则v(b)>v(d),故D正确;
E.CO转化率的越大,n总越小,由M=
可知,a点n总小,则M(a)>M(c),故E错误;
故答案为:BCD;
(4)a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),由电荷守恒可知C(NH+4)+C(H+)=C(Cl?)+C(OH?),则C(H+)=C(OH-),即溶液为中性;NH3?H2O?NH+4+OH-,C(OH-)=10-7mol/L,C(NH+4)=C(Cl?)=0.01mol/L,c(NH3?H2O)=(a-0.01)mol/L,则NH3?H2O的电离常数Kb=
=
,
故答案为:
.
开始 2 6 0
转化 x 3x 2x
平衡 (2-x)(6-3x) 2x
5min时反应达到平衡,此时容器内的压强变为原来的
| 3 |
| 4 |
由物质的量与压强成正比可知
| 2+6 |
| (2-x)+(6-3x)+2x |
| 4 |
| 3 |
则0-5min该反应的化学反应速率为V(H2)=
| ||
| 5min |
N2的转化率为
| 1mol |
| 2mol |
由平衡时的浓度可知化学平衡常数K=
| (1mol/L)2 |
| 0.5mol/L×(1.5mol/L)3 |
故答案为:0.3mol/(L.min);50%;0.59;
(2)由反应进程和盖斯定律可知,两步进程相加可得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-272kJ/mol+(+138kJ/mol)=-134kJ/mol,
即反应生成尿素的热化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol;
(3)A.该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A错误;
B.由图可知,CO的转化率越大,K越大,则K(a)>K(c),故B正确;
C.温度相同,K相同,则K(b)=K(d),故C正确;
D.压强越大,反应速率越大,b点压强大,则v(b)>v(d),故D正确;
E.CO转化率的越大,n总越小,由M=
| m |
| n |
故答案为:BCD;
(4)a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),由电荷守恒可知C(NH+4)+C(H+)=C(Cl?)+C(OH?),则C(H+)=C(OH-),即溶液为中性;NH3?H2O?NH+4+OH-,C(OH-)=10-7mol/L,C(NH+4)=C(Cl?)=0.01mol/L,c(NH3?H2O)=(a-0.01)mol/L,则NH3?H2O的电离常数Kb=
| c(OH-)c(NH4+) |
| c(NH3.H2O) |
| 10-9 |
| a-0.01 |
故答案为:
| 10-9 |
| a-0.01 |
点评:本题考查化学平衡的计算、盖斯定律计算反应热、化学反应速率及图象、电离及水解,综合性较强,题目难度中等,注重对高考常考考点的考查,(4)为解答的易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目

 运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.
运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义.