网址:http://m.1010jiajiao.com/timu3_id_205824[举报]
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
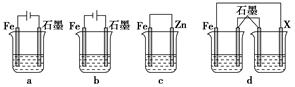
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。 查看习题详情和答案>>
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 |
甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
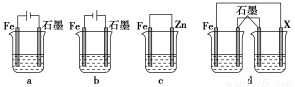
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。
(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。
查看习题详情和答案>>
ΔH=a kJ·mol-1。
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
ΔH1=+489.0 kJ·mol-1;
②C(s,石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1。则a=________。
(2)冶炼铁反应的平衡常数表达式K=________,温度升高后,K值________(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a、b、c装置中能保护铁的是________(填字母)。
②若用d装置保护铁,X极的电极材料应是________(填名称)。

(5)25 ℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39。25 ℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=________。
㈠CaCO3
| ||
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究.
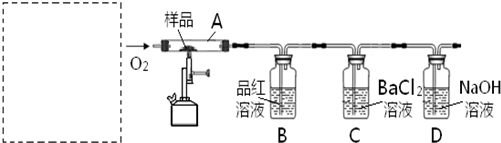
已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物Ⅱ---CaSO4 粉末
(1)实验一:①取样品Ⅰ装入A中.连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊.停止该步实验的正确操作是
②取反应后D中溶液滴加过量盐酸,无明显现象.由此得知实验一过程中:A中发生反应的化学方程式是
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是
a.酚酞的NH3?H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中.连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应.发现B中红色消失,C中出现白色浑浊.
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现.
由此得知实验二:A中发生的反应有
(3)实验三:取样品Ⅱ装入A中.连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是
(4)在中学化学实验室里,装置A通常只能选
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置.请将该药品和装置图示在图中的虚线框内
资料显示:在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4 ,从而减少SO2排放,该方法被称为钙基固硫。这一过程是通过以下两步反应实现的:
㈠ CaCO3 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。

已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物
Ⅱ---CaSO4 粉末
(1)实验一:①取样品Ⅰ装入A中。连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊。停止该步实验的正确操作是 。
②取反应后D中溶液滴加过量盐酸,无明显现象。由此得知实验一过程中: A中发生反应的化学方程式是 ;C中反应的离子方程式是 。
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是 。
a.酚酞的NH3·H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中。连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应。发现B中红色消失,C中出现白色浑浊。
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是 。
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现。
由此得知实验二: A中发生的反应有 (填选 “㈠”、“㈡”)。
(3)实验三:取样品Ⅱ装入A中。连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是 。比较实验一、二、三可知,如用该方法固硫,可行的基本条件是 。
(4)在中学化学实验室里,装置A通常只能选 为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是: 。
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置。请将该药品和装置图示在图中的虚线框内。
查看习题详情和答案>>