题目内容
资料显示:在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4,从而减少SO2排放,该方法被称为钙基固硫.这一过程是通过以下两步反应实现的:
㈠CaCO3
CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4
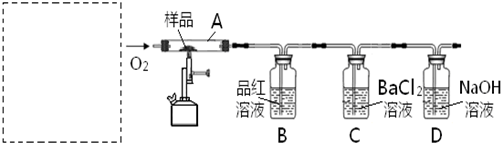
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究.
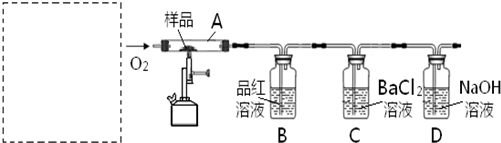
已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物Ⅱ---CaSO4 粉末
(1)实验一:①取样品Ⅰ装入A中.连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊.停止该步实验的正确操作是 .
②取反应后D中溶液滴加过量盐酸,无明显现象.由此得知实验一过程中:A中发生反应的化学方程式是 ;C中反应的离子方程式是 .
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是 .
a.酚酞的NH3?H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中.连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应.发现B中红色消失,C中出现白色浑浊.
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是 .
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现.
由此得知实验二:A中发生的反应有 (填选“㈠”、“㈡”).
(3)实验三:取样品Ⅱ装入A中.连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是 .比较实验一、二、三可知,如用该方法固硫,可行的基本条件是 .
(4)在中学化学实验室里,装置A通常只能选 为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是: .
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置.请将该药品和装置图示在图中的虚线框内 .
㈠CaCO3
| ||
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究.

已知实验所用样品:Ⅰ---S粉与CaCO3粉末的混合物Ⅱ---CaSO4 粉末
(1)实验一:①取样品Ⅰ装入A中.连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊.停止该步实验的正确操作是
②取反应后D中溶液滴加过量盐酸,无明显现象.由此得知实验一过程中:A中发生反应的化学方程式是
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是
a.酚酞的NH3?H2O溶液 b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液 d.Br2的CCl4溶液
(2)实验二:①取样品Ⅰ装入A中.连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应.发现B中红色消失,C中出现白色浑浊.
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现.
由此得知实验二:A中发生的反应有
(3)实验三:取样品Ⅱ装入A中.连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是
(4)在中学化学实验室里,装置A通常只能选
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置.请将该药品和装置图示在图中的虚线框内
分析:(1)①反应进行是用喷灯加热玻璃管,停止反应进行需要撤下喷灯,通入氧气一段时间至冷却,防止发生倒吸;
②反应后D中溶液滴加过量盐酸,无明显现象说明玻璃管中发生的是硫和氧气反应生成二氧化硫;C中是二氧化硫和氧气通入氯化钡溶液会反应生成硫酸钡沉淀;
③替代B中品红溶液出现相同现象,ab都可以和二氧化硫反应溶液颜色褪去,c、酚酞的NaHCO3溶液,酚酞在PH大于8时才会开始变色;d、二氧化硫通入Br2的CCl4溶液中无水不反应;
(2)②D中溶液滴加过量盐酸,出现大量无色气泡,说明玻璃管中受热反应生成了二氧化碳气体,③将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现说明存在硫酸根离子;说明发生了反应一和二;
(3)依据硫酸钙受热分解生成了二氧化硫,结合氧化还原反应电子守恒、原子守恒判断生成产物;由实验一和二、三可知钙基固硫需要把硫元素生成较稳定的硫酸钙,温度过高硫酸钙分解失去钙基固硫的目的;
(4)反应温度再1000°C左右,玻璃管需要耐高温,选择石英管,缺点是二氧化硅和生成的氧化钙会发生反应生成硅酸钙;
(5)空气中含有二氧化碳会对后续反应现象产生干扰,水蒸气会使玻璃管发生炸裂;需要先通过装有碱石灰的干燥管除去二氧化碳和水蒸气的装置.
②反应后D中溶液滴加过量盐酸,无明显现象说明玻璃管中发生的是硫和氧气反应生成二氧化硫;C中是二氧化硫和氧气通入氯化钡溶液会反应生成硫酸钡沉淀;
③替代B中品红溶液出现相同现象,ab都可以和二氧化硫反应溶液颜色褪去,c、酚酞的NaHCO3溶液,酚酞在PH大于8时才会开始变色;d、二氧化硫通入Br2的CCl4溶液中无水不反应;
(2)②D中溶液滴加过量盐酸,出现大量无色气泡,说明玻璃管中受热反应生成了二氧化碳气体,③将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现说明存在硫酸根离子;说明发生了反应一和二;
(3)依据硫酸钙受热分解生成了二氧化硫,结合氧化还原反应电子守恒、原子守恒判断生成产物;由实验一和二、三可知钙基固硫需要把硫元素生成较稳定的硫酸钙,温度过高硫酸钙分解失去钙基固硫的目的;
(4)反应温度再1000°C左右,玻璃管需要耐高温,选择石英管,缺点是二氧化硅和生成的氧化钙会发生反应生成硅酸钙;
(5)空气中含有二氧化碳会对后续反应现象产生干扰,水蒸气会使玻璃管发生炸裂;需要先通过装有碱石灰的干燥管除去二氧化碳和水蒸气的装置.
解答:解:(1)①停止反应进行,需要撤掉酒精喷灯,通氧气到玻璃管冷却,避免液体倒吸炸裂玻璃管,故答案为:撤掉喷灯,继续通入O2至A冷却;
②取反应后D中溶液滴加过量盐酸,无明显现象,说明无二氧化碳生成,所以加热时制发生了硫和氧气反应生成二氧化硫气体,该反应为S+O2
SO2;C中生成白色沉淀是因为二氧化硫在过量氧气中和氯化钡发生反应生成硫酸钡沉淀,由原子守恒配平写出离子方程式为2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+,
故答案为:S+O2
SO2;2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+;
③a.酚酞的NH3?H2O溶液呈红色,通入二氧化硫气体反应后溶液变为无色,故a符合;
b.酸性KMnO4溶液紫红色,通入二氧化硫被高锰酸钾氧化为硫酸,反应后溶液褪色,故b符合;
c.酚酞的NaHCO3溶液不一定呈红色,不能检验生成的二氧化硫气体,故c不符合;
d.Br2的CCl4溶液通入二氧化硫不能反应褪色,故d不符合;
故答案为:ab;
(2)②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,说明二氧化硫被吸收和还有二氧化碳气体生成,D中反应的离子方程式是CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O;
③依据上述实验分析可知B中红色消失,C中出现白色浑浊,取反应后D中溶液滴加过量盐酸,出现大量无色气泡,说明生成二氧化硫和二氧化碳,应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现,说明生成了硫酸根离子,判断反应发生了(一)、(二);
故答案为:(一)、(二);
(3)取样品Ⅱ装入A中.连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,说明有二氧化硫生成,结合氧化还原电子守恒分析一定生成氧气,依据原子守恒、电子守恒写出化学方程式:2CaSO4
2CaO+2SO2↑+O2↑;分析实验可知由实验一和二、三可知钙基固硫需要把硫元素生成较稳定的硫酸钙,温度过高硫酸钙分解失去钙基固硫的目的;钙基固硫的温度应控制1000°C左右,
故答案为:2CaSO4
2CaO+2SO2↑+O2↑;燃烧温度需1000℃左右;
(4)因为实验制备需要高温下进行,实验玻璃管应选用耐高温的材料制成的玻璃管,石英玻璃管耐高温可以选用,但石英中二氧化硅是酸性氧化物和生成的碱性氧化物氧化钙会发生反应生成硅酸钙,反应的化学方程式为:SiO2+CaO
CaSiO3,
故答案为:石英;SiO2+CaO
CaSiO3;
(5)空气中含有二氧化碳会对后续反应现象产生干扰,水蒸气会使玻璃管发生炸裂;需要先通过装有碱石灰的干燥管除去二氧化碳和水蒸气的装置,装置图为: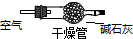 ,故答案为:
,故答案为: .
.
②取反应后D中溶液滴加过量盐酸,无明显现象,说明无二氧化碳生成,所以加热时制发生了硫和氧气反应生成二氧化硫气体,该反应为S+O2
| ||
故答案为:S+O2
| ||
③a.酚酞的NH3?H2O溶液呈红色,通入二氧化硫气体反应后溶液变为无色,故a符合;
b.酸性KMnO4溶液紫红色,通入二氧化硫被高锰酸钾氧化为硫酸,反应后溶液褪色,故b符合;
c.酚酞的NaHCO3溶液不一定呈红色,不能检验生成的二氧化硫气体,故c不符合;
d.Br2的CCl4溶液通入二氧化硫不能反应褪色,故d不符合;
故答案为:ab;
(2)②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,说明二氧化硫被吸收和还有二氧化碳气体生成,D中反应的离子方程式是CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O;
③依据上述实验分析可知B中红色消失,C中出现白色浑浊,取反应后D中溶液滴加过量盐酸,出现大量无色气泡,说明生成二氧化硫和二氧化碳,应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现,说明生成了硫酸根离子,判断反应发生了(一)、(二);
故答案为:(一)、(二);
(3)取样品Ⅱ装入A中.连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,说明有二氧化硫生成,结合氧化还原电子守恒分析一定生成氧气,依据原子守恒、电子守恒写出化学方程式:2CaSO4
| ||
故答案为:2CaSO4
| ||
(4)因为实验制备需要高温下进行,实验玻璃管应选用耐高温的材料制成的玻璃管,石英玻璃管耐高温可以选用,但石英中二氧化硅是酸性氧化物和生成的碱性氧化物氧化钙会发生反应生成硅酸钙,反应的化学方程式为:SiO2+CaO
| ||
故答案为:石英;SiO2+CaO
| ||
(5)空气中含有二氧化碳会对后续反应现象产生干扰,水蒸气会使玻璃管发生炸裂;需要先通过装有碱石灰的干燥管除去二氧化碳和水蒸气的装置,装置图为:
 ,故答案为:
,故答案为: .
.点评:本题考查物质制备实验的方案设计,性质验证,反应现象和实验步骤的分析判断,题干信息的应用能力,注意实验步骤中的实验目的和要求是解题的关键,题目难度中等.

练习册系列答案
相关题目
 CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
CaO+CO2 ㈡ 2CaO+2SO2+O2 =2CaSO4
 CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4
CaO+CO2 ㈡2CaO+2SO2+O2=2CaSO4