网址:http://m.1010jiajiao.com/timu3_id_205694[举报]
回答下列问题:
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应.写出该反应的离子方程式:
(2)实验室欲用18.4mol?L-1的浓硫酸配制100mL 5.0mol?L-1的硫酸溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(3)某同学用如图1所示装置进行过滤操作.
①请指出其中的错误之处:
②过滤后,洗涤过滤器中少量沉淀的方法是
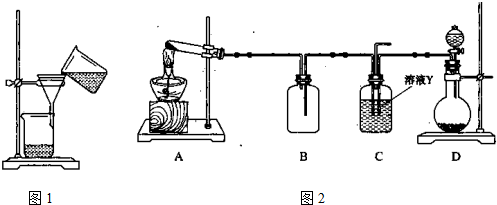
(4)某同学用图2所示实验装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2.
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为
②下列各项制备实验中,也可利用装置D处仪器完成的是
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素.用pH试纸测定该溶液pH的方法是
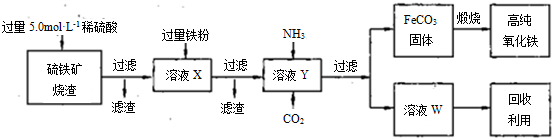
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:

回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式:
。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2

①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
查看习题详情和答案>>
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下: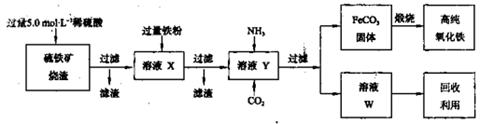
回答下列问题: (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 |
| B.Cu与浓硫酸反应生成SO2 |
| C.由KMnO4分解制O2 |
| D.乙醇与乙酸反应制备乙酸乙酯 |
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示) 查看习题详情和答案>>
(15分)高纯氧化铁(α—Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO,还含有SiO2等杂质)为原料制备高纯氧化铁的步骤如下:
回答下列问题:
 (1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(1)上述实验所涉及的反应中,有一个反应既属于化合反应,又属于氧化还原反应。写出该反应的离子方程式: 。
(2)实验室欲用18.4mol·L-1的浓硫酸配制100mL 5.0mol·L-1的硫酸
溶液,所用的玻璃仪器胶头滴管、量筒、烧杯、玻璃棒外,还有
(填写仪器名称)。
(3)某同学用右图所示装置进行过滤操作。
①请指出其中的错误之处: ;
②过滤后,洗涤过滤器中少量沉淀的方法是 。
(4)某同学用下图所示装置(尾气吸收装置未画出)实验向溶液Y中通入NH3和CO2
①下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH
e.浓氨水 f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 和 (用药品序号填空);装置D处药品的最佳选择为 和 (用药品序号填空)。
②下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2
B.Cu与浓硫酸反应生成SO2
C.由KMnO4分解制O2
D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
③写出上述装置A处的试管中所发生反应的化学方程式 。
④若通入一定量的NH3和CO2后,装置C处的溶液中只含有S、N、H、O四种元素。用pH试纸测定该溶液pH的方法是 ;若该溶液呈中性,则溶液中的NH+4和SO2-4的物质的量浓度间的数量关系为 。(离子的浓度用符号[NH+4]和[SO2-4]表示)
查看习题详情和答案>>
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④检漏、转移、洗涤 ⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是
A.10ml B.25ml C.50ml D.100ml
(2)第③步实验的操是
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线
(4)转移溶液和直接加蒸馏水于容量瓶中要注意“两靠”:一靠是盛溶液的烧杯口靠在玻璃棒上部,二靠是玻璃棒下端靠在
(5)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”、“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水
②所用过的烧杯、玻璃棒未洗涤
③加水超过刻度线后,用胶头滴管吸出多余的液体