摘要:工业品纯碱中常含有少量的NaCl等杂物.图中的仪器装置可用来测定纯碱中Na2CO3的质量分数.图中标号:①--空气,②--某溶液,③--纯碱样品,④--稀H2SO4,⑤--浓H2SO4,⑥--碱石灰,⑦--碱石灰 实验步骤是:①检查装置的气密性,②准确称量盛有碱石灰的干燥管I的质量(设为m1 g),③准确称量一定量的纯碱的质量(设为m2 g).并将其放入广口瓶中,④从分液漏斗中缓缓滴入稀H2SO4.至不再产生气体为止,⑤缓缓鼓入空气数分钟.然后称量干燥管I的总质量(设为m3 g).根据上述实验.回答下列问题: (1)鼓入空气的目的是 (2)装置A中液体②应为 .其作用是 .如撤去装置A.直接向装置B中缓缓鼓入空气.测定结果将 (填“偏大 “偏小 或“不变 ) (3)装置C的作用是 .如果撤去装置C.则会导致实验结果 (填“偏大 “偏小 或“不变 ) (4)干燥管II的作用是 (5)上述实验的操作④和⑤.都要求缓缓进行.其理由是 .如果这两步操作太快.则会导致实验测定结果 (填“偏大 “偏小 或“不变 ) (6)根据实验.纯碱中质量分数的计算式为
网址:http://m.1010jiajiao.com/timu3_id_205548[举报]
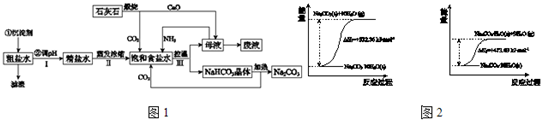
工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3.其过程如图1所示.
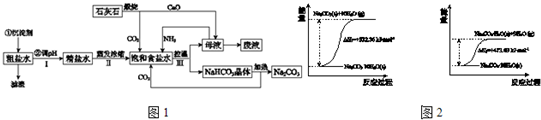
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有______.
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是______.
(3)向饱和食盐水中首先通入的气体是______,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是______.
(4)碳酸钠晶体失水的能量变化示意图如图2:
Na2CO3?H2O (s) 脱水反应的热化学方程式是______.
(5)产品纯碱中常含有NaCl.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是______.
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是______.
查看习题详情和答案>>
工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3.其过程如图1所示.
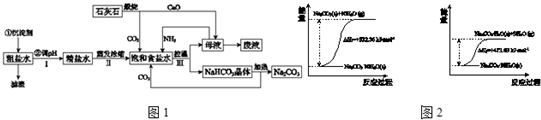
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有______.
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是______.
(3)向饱和食盐水中首先通入的气体是______,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是______.
(4)碳酸钠晶体失水的能量变化示意图如图2:
Na2CO3?H2O (s) 脱水反应的热化学方程式是______.
(5)产品纯碱中常含有NaCl.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是______.
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是______.
查看习题详情和答案>>

请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有______.
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是______.
(3)向饱和食盐水中首先通入的气体是______,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是______.
(4)碳酸钠晶体失水的能量变化示意图如图2:
Na2CO3?H2O (s) 脱水反应的热化学方程式是______.
(5)产品纯碱中常含有NaCl.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是______.
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是______.
目前,大部分食盐用来生产氯气、氢气、烧碱和纯碱,进一步加工成各种含氯含钠的制品.如盐酸、漂粉精、氯化铁和聚氯乙烯等.
根据所学知识,完成下列填空:
(1)以食盐为原料,生产氯气、氢气、烧碱的反应方程式是 ,是中国现代化工之母-- (填工业种类)的基本反应.
(2)工业上常用氢气和氯气化合制取氯化氢气体.如图1是氢气和氯气化合的合成塔,其燃烧器的A管应通入 (填化学式),理由是 .
(3)如图2,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,精制饱和氯化钠溶液从 (选填“阳”或“阴”)极区补充.电解池中的铁棒在碱性条件下发生的电极反应

式是 .
(4)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3.其过程如图所示:

在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有 (填化学式).过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是 .
(5)接(4)题,产品纯碱中常含有NaCl.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是 .
查看习题详情和答案>>
根据所学知识,完成下列填空:
(1)以食盐为原料,生产氯气、氢气、烧碱的反应方程式是
(2)工业上常用氢气和氯气化合制取氯化氢气体.如图1是氢气和氯气化合的合成塔,其燃烧器的A管应通入
(3)如图2,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,精制饱和氯化钠溶液从

式是
(4)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3.其过程如图所示:

在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有
(5)接(4)题,产品纯碱中常含有NaCl.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是
工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
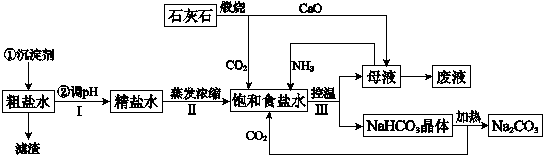
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有_____________。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是_________________。
(3)向饱和食盐水中首先通入的气体是______,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是__________________。
(4)碳酸钠晶体失水的能量变化示意图如下:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有_____________。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是_________________。
(3)向饱和食盐水中首先通入的气体是______,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是__________________。
(4)碳酸钠晶体失水的能量变化示意图如下:
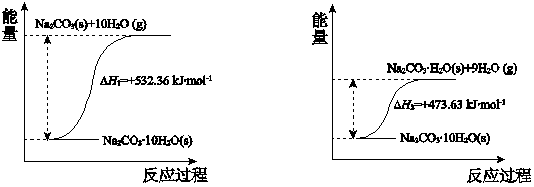
Na2CO3·H2O(s) 脱水反应的热化学方程式是___________。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是__________。
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是________________________。
查看习题详情和答案>>
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是__________。
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是________________________。
(2012?西城区一模)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3.其过程如图1所示.
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是
(3)向饱和食盐水中首先通入的气体是
(4)碳酸钠晶体失水的能量变化示意图如图2:
Na2CO3?H2O (s) 脱水反应的热化学方程式是
(5)产品纯碱中常含有NaCl.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是
.
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是
查看习题详情和答案>>

请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有
CaCO3、Mg(OH)2
CaCO3、Mg(OH)2
.(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是
2NH4Cl+CaO=CaCl2+2NH3↑+H2O
2NH4Cl+CaO=CaCl2+2NH3↑+H2O
.(3)向饱和食盐水中首先通入的气体是
NH3
NH3
,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl
NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl
.(4)碳酸钠晶体失水的能量变化示意图如图2:
Na2CO3?H2O (s) 脱水反应的热化学方程式是
Na2CO3?H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73kJ?mol-1
Na2CO3?H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73kJ?mol-1
.(5)产品纯碱中常含有NaCl.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体.则该产品中Na2CO3的质量分数是
| 106(b-a) |
| 11a |
| 106(b-a) |
| 11a |
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是
CH4-8e-+4CO32-=5CO2+2H2O
CH4-8e-+4CO32-=5CO2+2H2O
.