网址:http://m.1010jiajiao.com/timu3_id_204250[举报]
写出下列的离子方程式:
①铁粉加入稀H2SO4中: ________ _______ _______;
②氢氧化钡中吹入少量CO2变浑浊: _________ ____________ ;
③碳酸钙中加入盐酸产生气泡: __________________ _____________。
查看习题详情和答案>>
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
| Fe2+ | 7.6 | 9.7 | |
| Fe3+ | 2.7 | 3.7 | |
| Al3+ | 3.8 | 4.7 | >8.5 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:
(2)写出氧化过程中主要反应的离子方程式:
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至
(4)滤渣的主要成分有
(5)下列各组试剂中,能准确测定尾气中SO2含量的是
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3废气,可得到硫酸锰晶体质量为

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:
(2)写出氧化过程中主要反应的离子方程式:
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是
(4)滤渣的主要成分有
(5)下列各组试剂中,能准确测定尾气中SO2含量的是
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液.
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
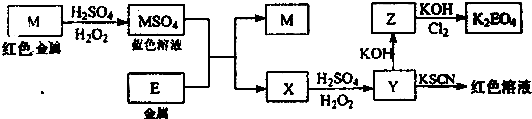
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式
(2)检验X中阳离子的方法和现象是
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色.试用离子方程式表示溶液变为蓝色的原因:
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、烧杯、玻璃棒、漏斗、铁架台外,还需要用到的硅酸盐仪器有
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图.A中试剂是盐酸.
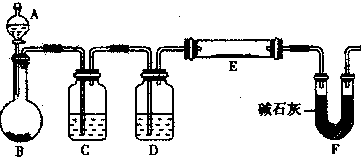
①装置D的作用
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”?
③该实验设计是否还有不足之处?若有请指出并改进,如没有本问可不答.
(6)试说明K2EO4可用作高效净水剂的原因
垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
 (1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
写出滤渣B中发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是2~3.2,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中,可用作调整溶液C的pH的试剂是 (填序号)
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(3)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、
(填操作名称)、自然干燥。
(4)选用提供的试剂,设计实验验证铁红中是否含有FeO。
提供的试剂:a.稀盐酸 b.稀硫酸 c.KSCN溶液 d.KMnO4溶液 e.NaOH溶液 f.碘水
所选用的试剂为 (填序号);证明铁红中含有FeO的实验现象为 。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1,将0.3mol的铜放入并充分反应后,被还原的HNO3的物质的量为 。
查看习题详情和答案>>