题目内容
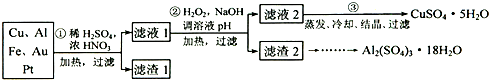
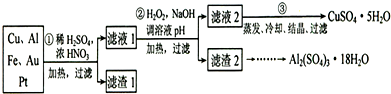
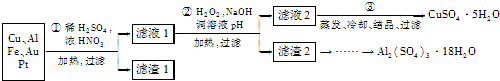
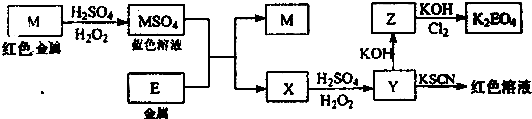
信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,将得到的红色金属M和金属E进行如框图所示转化,获得高效净水剂K2EO4.
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式
(2)检验X中阳离子的方法和现象是
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色.试用离子方程式表示溶液变为蓝色的原因:
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、烧杯、玻璃棒、漏斗、铁架台外,还需要用到的硅酸盐仪器有
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图.A中试剂是盐酸.
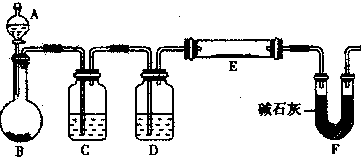
①装置D的作用
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”?
③该实验设计是否还有不足之处?若有请指出并改进,如没有本问可不答.
(6)试说明K2EO4可用作高效净水剂的原因
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式
Cu+H2O2+2H+=Cu2++2H2O
Cu+H2O2+2H+=Cu2++2H2O
.(2)检验X中阳离子的方法和现象是
取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色
取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色
.(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色.试用离子方程式表示溶液变为蓝色的原因:
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
.(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、烧杯、玻璃棒、漏斗、铁架台外,还需要用到的硅酸盐仪器有
蒸发皿
蒸发皿
(填写仪器名称).(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图.A中试剂是盐酸.

①装置D的作用
吸收水蒸气,干燥H2
吸收水蒸气,干燥H2
;②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”?
从A瓶中逐滴加入液体
从A瓶中逐滴加入液体
在这两步之间还应进行的操作是检验H2的纯度
检验H2的纯度
.③该实验设计是否还有不足之处?若有请指出并改进,如没有本问可不答.
(6)试说明K2EO4可用作高效净水剂的原因
高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂
高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂
.分析:根据题中信息,红色金属与稀H2SO4和H2O2反应生成蓝色溶液,生成的溶液中含有铜离子,所以M为金属铜;由于金属E反应后进入溶液X,X被双氧水氧化成Y,Y与硫氰化钾显示红色,证明金属E为铁,X为硫酸亚铁,Y为硫酸铁,
(1)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水;
(2)检验X中阳离子为亚铁离子,根据检验亚铁离子的方法完成;
(3)取X的溶液在空气中放置后,溶液中的亚铁离子被氧化成了铁离子,铁离子具有氧化性,能够氧化碘离子;
(4)硫酸铜溶液获得硫酸铜晶体,需要经过蒸发浓度、冷却结晶等操作,用到的仪器有酒精灯、烧杯、玻璃棒、漏斗、铁架台和蒸发皿;
(5)①装置D装有浓硫酸,用于干燥氢气;
②必须先通氢气赶走空气再加热,避免发生危险;加热前需要检验氢气的纯度;
③反应结束必须对尾气进行处理;
(6)高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂.
(1)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水;
(2)检验X中阳离子为亚铁离子,根据检验亚铁离子的方法完成;
(3)取X的溶液在空气中放置后,溶液中的亚铁离子被氧化成了铁离子,铁离子具有氧化性,能够氧化碘离子;
(4)硫酸铜溶液获得硫酸铜晶体,需要经过蒸发浓度、冷却结晶等操作,用到的仪器有酒精灯、烧杯、玻璃棒、漏斗、铁架台和蒸发皿;
(5)①装置D装有浓硫酸,用于干燥氢气;
②必须先通氢气赶走空气再加热,避免发生危险;加热前需要检验氢气的纯度;
③反应结束必须对尾气进行处理;
(6)高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂.
解答:解:根据题中信息,红色金属与稀H2SO4和H2O2反应生成蓝色溶液,生成的溶液中含有铜离子,所以M为金属铜;由于金属E反应后进入溶液X,X被双氧水氧化成Y,Y与硫氰化钾显示红色,证明金属E为铁,X为硫酸亚铁,Y为硫酸铁,
(1)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水,即Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(2)检验X中阳离子,就是检验溶液中存在亚铁离子,方法为:取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色,
故答案为:取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色;
(3)由于X的溶液在空气中放置后,溶液中的亚铁离子被氧化成了铁离子,铁离子具有氧化性,能够氧化碘离子,发生的反应为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(4)由于硫酸铜溶液获得硫酸铜晶体,需要经过蒸发浓度、冷却结晶等操作,用到的仪器有酒精灯、烧杯、玻璃棒、漏斗、铁架台和蒸发皿,
故答案为:蒸发皿;
(5)①D装置盛有浓硫酸,作用是干燥氢气,
故答案为:吸收水蒸气,干燥H2;
②氢气还原氧化铜,必须先通氢气赶走空气再加热,避免发生危险,所以应该先从A瓶中逐滴加入液体;加热前需要检验氢气的纯度;
故答案为:从A瓶中逐滴加入液体; 检验H2的纯度;
③在反应结束后,必须对尾气进行处理,处理方法可以将多余的氢气燃烧掉,
答:有不足,未进行尾气处理,可用酒精灯将未反应的氢气燃烧掉;
(6)由于高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂,
故答案为:高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂.
(1)铜和硫酸在双氧水的作用下发生反应生成硫酸铜和水,即Cu+H2O2+2H+=Cu2++2H2O,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(2)检验X中阳离子,就是检验溶液中存在亚铁离子,方法为:取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色,
故答案为:取X溶液少许于试管中,滴入几滴KSCN溶液,溶液不显红色,再向试管中加入几滴新制氯水,溶液显红色;
(3)由于X的溶液在空气中放置后,溶液中的亚铁离子被氧化成了铁离子,铁离子具有氧化性,能够氧化碘离子,发生的反应为:2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(4)由于硫酸铜溶液获得硫酸铜晶体,需要经过蒸发浓度、冷却结晶等操作,用到的仪器有酒精灯、烧杯、玻璃棒、漏斗、铁架台和蒸发皿,
故答案为:蒸发皿;
(5)①D装置盛有浓硫酸,作用是干燥氢气,
故答案为:吸收水蒸气,干燥H2;
②氢气还原氧化铜,必须先通氢气赶走空气再加热,避免发生危险,所以应该先从A瓶中逐滴加入液体;加热前需要检验氢气的纯度;
故答案为:从A瓶中逐滴加入液体; 检验H2的纯度;
③在反应结束后,必须对尾气进行处理,处理方法可以将多余的氢气燃烧掉,
答:有不足,未进行尾气处理,可用酒精灯将未反应的氢气燃烧掉;
(6)由于高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂,
故答案为:高铁酸钾具有强氧化性,杀菌后自身被还原为Fe3+,Fe3+水解后生成的氢氧化铁胶体又具有较强的吸附性,因而高铁酸钾可有做高效净水剂.
点评:本题考查了制取净水剂K2EO4的方法,本题是一道探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能正确作答.

练习册系列答案
相关题目